Журнал «Травма» Том 12, №1, 2011
Вернуться к номеру
Выбор оптимального метода тромбопрофилактики в травматологии
Авторы: Зубков В.И., Тхоревский А.В., Лазарчук Н.Д. Главный военный клинический медицинский центр ГКВГ МО Украины, кафедра реанимации и анестезиологии, г. Киев
Рубрики: Травматология и ортопедия
Версия для печати
В лечении больных с тяжелыми травмами опорно-двигательного аппарата одной из важных проблем является профилактика тромбоэмболических осложнений. В работе показано, что применение Цибора® на фоне адекватной регионарной анестезии позволяет провести более эффективную, безопасную и адекватную профилактику тромбоэмболических осложнений.
Введение
Одной из важных проблем в лечении больных с тяжелыми травмами опорно-двигательного аппарата является профилактика тромбоэмболических осложнений, из которых наиболее часто встречаются тромбозы вен нижних конечностей и тромбоэмболии легочной артерии (ТЭЛА). По данным метаанализов, риск тромбоэмболических осложнений при травмах и ортопедических операциях колеблется в пределах от 40 до 60 %. По данным Geerts и соавт. [1], без проведения адекватной профилактики тромбоз глубоких вен (ТГВ) нижних конечностей развился у 42–57 %, а ТЭЛА — у 0,9–28 % пациентов после эндопротезирования тазобедренного сустава. В травматолого-ортопедических отделениях стационара летальность, обусловленная развитием ТЭЛА, составляет 17,6–25 % всех смертельных исходов.
При крупных ортопедических операциях имеет место полностью сформированная триада Вирхова (застой крови, повышение активности свертывающей системы и повреждение стенки сосудов), что и обусловливает необходимость тромбопрофилактики [3].
Тип анестезии (местная или общая) также играет важную роль. S.T. Woolson (1996) отметил, что ТГВ при проведении эндопротезирования крупных суставов под эндотрахеальной анестезией встречался в 11 %, а при использовании эпидуральной анестезии — в 4 % случаев.
Применение регионарной анестезии, адекватность анестезии, поддержание гемодинамики и реологических свойств крови, сокращение продолжительности операции, тщательный гемостаз, соблюдение правил работы со жгутом, кровесберегающие хирургические приемы на фоне применения нефракционированного (НФГ) и низкомолекулярных гепаринов (НМГ) являются лучшими методами профилактики.
При всей эффективности НФГ следует отметить, что он не лишен целого ряда побочных реакций, некоторые из них могут существенно повлиять на состояние пациента и на исход основного заболевания. Определенные проблемы связывают с проведением эпидуральной и спинальной анестезии у пациентов, получающих НМГ с целью тромбопрофилактики. В то же время на протяжении последних 10–12 лет, когда НМГ стали широко использоваться в Европе, не было отмечено увеличения числа эпидуральных гематом у пациентов, оперированных в условиях нейроаксиальной анестезии.
Примерно у 3 % пациентов, получающих НФГ, развивается гепарин-индуцированная тромбоцитопения, которая может ухудшить прогноз венозного или артериального тромбоза [2]. Длительное применение НФГ может сопровождаться и развитием остео- пороза: значительное снижение костной плотности отмечалось у 30 % больных, получающих длительную терапию НФГ, а переломы позвоночника — у 2–3 % пациентов [8]. Однако благодаря уменьшению молекулярной массы (ММ) их антитромботическое действие более селективно и потому более предсказуемо. При применении НМГ гепарин-индуцированная тромбоцитопения развивается значительно реже по сравнению с НФГ; кроме того, применение НМГ ассоциируется с гораздо меньшим риском остеопороза по сравнению с НФГ [8, 10].
В последние годы препараты из группы НМГ являются препаратами выбора не только для первичной профилактики венозных тромбоэмболических осложнений, но и для их лечения, а также с успехом применяются для вторичной тромбопрофилактики [2].
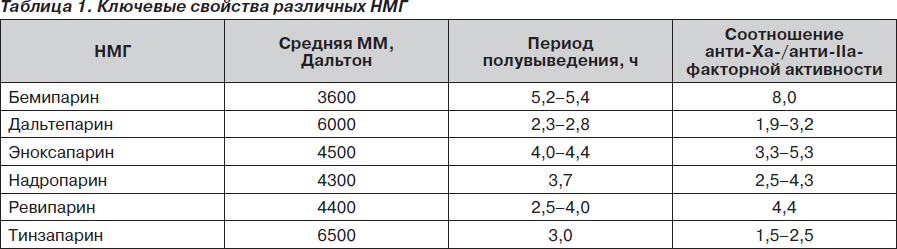
В настоящее время на мировом фармацевтическом рынке присутствует около десятка различных НМГ. Все они являются производными стандартного гепарина и обладают сходным антикоагулянтным действием, хотя и имеют значительные индивидуальные различия на молекулярном уровне (табл. 1) [6, 10].
Среди НМГ наибольшего внимания заслуживает бемипарин, имеющий наилучший фармакологический профиль среди НМГ: самый низкий молекулярный вес — 3600 Дальтон, самое высокое соотношение анти-Ха-/анти-IIa-факторной активности — 8 : 1. В сравнительных исследованиях [9, 10] показаны наивысшая анти-Ха-факторная активность бемипарина среди НМГ, минимальное влияние на тромбиновое время, т.е. бемипарин (препарат Цибор®) сочетает в себе высокий антитромботический эффект с минимальным риском кровотечений. Привлекательной особенностью бемипарина является возможность введения эффективной дозы через 6 часов после операции, что позволяет уменьшить риск повышенной кровоточивости во время операции [6, 10].
Целью нашей работы был выбор оптимального метода тромбопрофилактики в клинике травматологии Главного военного клинического центра, оценка эффективности и безопасности послеоперационного старта фармакологической тромбопрофилактики в сравнении с традиционным дооперационным.
Материал и методы исследования
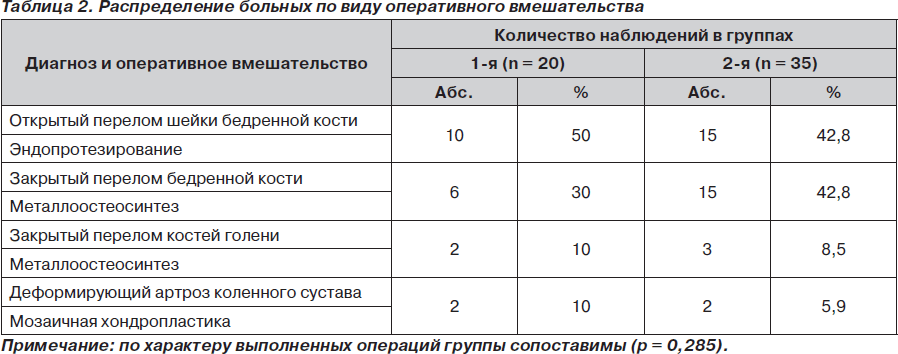
Под нашим наблюдением находилось 55 пациентов, оперированных по поводу переломов костей нижних конечностей или деформирующего остеоартроза в первом полугодии 2009 года, которые были разделены на 2 группы. Первую группу составили 20 пациентов (12 мужчин и 8 женщин), у которых тромбопрофилактику проводили бемипарином (препаратом Цибор®) в дозе 3500 МЕ, первое введение через 6 часов после операции. Во второй группе (35 больных — 21 мужчина и 14 женщин) для профилактики использовали другие низкомолекулярные гепарины — эноксапарин (Клексан®) в дозе 40 мг, надропарин (Фраксипарин®) 0,4–0,6 мл, дальтепарин (Фрагмин®) 5000 МЕ; тромбопрофилактику начинали за 12 часов до оперативного вмешательства.
Проводили комплексное клинико-лабораторное обследование всех госпитализированных больных: определение содержания общего белка, мочевины, креатинина, глюкозы, билирубина, ионов калия и натрия в сыворотке крови, гемоглобина (Hb), гематокрита (Ht), количество лейкоцитов в крови, кислотно-основное состояние артериальной и венозной крови с помощью аппарата «Аструп АВС-2А», насыщение гемоглобина крови (HbO2) в капиллярной крови пульсоксиметром «Ютас», коагулограммы унифицированными методами, время свертывания крови по Ли — Уайту, диурез.
Критерии включения: возраст 18–75 лет, плановые оперативные вмешательства по поводу переломов костей нижних конечностей, пациенты без сопутствующих заболеваний или с сопутствующими заболеваниями в стадии стойкой ремиссии.
Критерии исключения: известная аллергия на НМГ, наличие тромбофлебита нижних конечностей, наличие ТГВ менее 3 месяцев назад, тяжелая печеночная недостаточность, наличие кровотечений в анамнезе и перед операцией.
Обе группы были сопоставимы по возрастному и половому признакам, а также по сопутствующей патологии.
Всем пациентам проводилась стандартная профилактика инфекционных осложнений с применением антибактериальных препаратов.
В качестве анестезиологического пособия для проведения оперативного вмешательства использовалась спинномозговая анестезия.
Противопоказаниями к спинномозговой анестезии были: острая гиповолемия, острая анемия, выраженная дегидратация, неврологические демиелинизирующие заболевания, перенесенный в последние 6 месяцев инфаркт миокарда или стенокардия II–III функционального класса, сепсис и наличие инфекции в месте интратекального введения анестетика.
Показатели гемостаза, при которых пациентам выполняли спинномозговую анестезию:
— протромбиновый индекс (ПТИ) не менее 70 %;
— международное нормализованное отношение не более 1,5;
— активированное частичное тромбиновое время (АЧТВ) не более 50 с;
— количество тромбоцитов: не менее 100 х 109/л.
Субарахноидальное пространство в условиях хирургической асептики пунктировали на уровне L2–L3, L3–L4 в положении пациента на боку. Для пункции использовали иглы Quincke и Pencil point 22G и 25G фирмы Braun. Кожу между остистыми отростками позвонков анестезировали 1% раствором лидокаина. Спинальное пространство верифицировали по появлению ликвора с помощью аспирационной пробы, после чего медленно за 2–3 минуты вводили 0,5% маркаин (2–3 мл). Перед извлечением спинальной иглы вновь вводили обтурирующий мандрен. Больного осторожно, без резких движений укладывали на операционном столе в горизонтальное положение.
Для профилактики выраженных гемодинамических сдвигов проводили предоперационную гемодилюцию в объеме не менее 800–1200 мл растворов кристаллоидов со скоростью 15–18 мл/мин, 250–500 мл растворов гидрокисэтилкрахмала 6% 200/0,5 (Рефортан® 6%) со скоростью 8–10 мл/мин. Инфузию растворов продолжали и во время оперативного вмешательства.
Подготовка и проведение анестезии осуществлялись на основе стандартов ASA. Премедикация накануне и в день операции была традиционной и включала в себя психологическую подготовку, информированное согласие больного на вид анестезии, медикаментозную подготовку. Вечером накануне операции назначались препараты диазепинового ряда, а утром, за 30–40 минут до операции, — aнтигистаминные препараты (димедрол, супрастин) в обычных дозировках в комбинации с промедолом 2% — 1 мл.
Бензодиазепиновые препараты (сибазон, реланиум, седуксен) использовались нами и во время операции для устранения эмоционального дискомфорта (в дозе 0,1–0,15 мг/кг).
Результаты и их обсуждение
Средний возраст больных составил 63,5 ± 3,4 года, разница между мужчинами и женщинами по возрасту статистически недостоверна. Все обследованные больные перенесли оперативные вмешательства на нижних конечностях под спинномозговой анестезии. Виды оперативных вмешательств приведены в табл. 2.
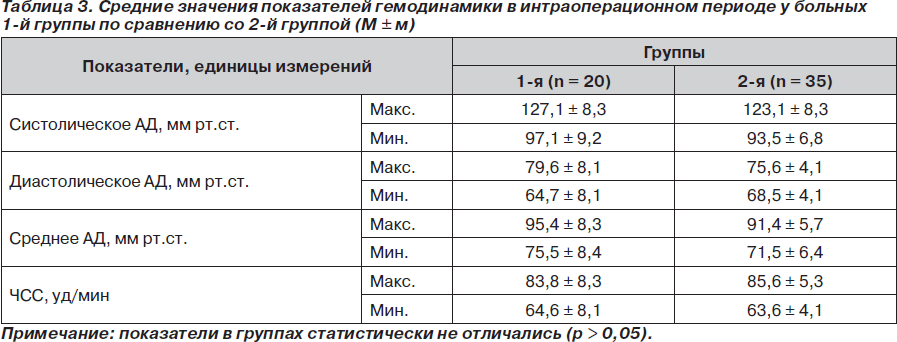
Во время анестезии и в постнаркозном периоде у пациентов обеих групп осложнений не отмечено. В связи с тем что продолжительность операции и травматичность были разными, особое внимание мы уделяли колебаниям значений артериального давления (систолического, диастолического, среднего) и частоты пульса во время операции, анализируя максимальные и минимальные их величины.
Средние значения показателей гемодинамики в операционной представлены в табл. 3.
Анализ показателей, характеризующих состояние гомеостаза больных во время операции и в раннем послеоперационном периоде, позволил нам сделать вывод о том, что использование спинномозговой анестезии с умеренной медикаментозной седацией является достаточно эффективным для защиты больных пожилого и старческого возраста от операционного стресса при оперативных вмешательствах на нижних конечностях.
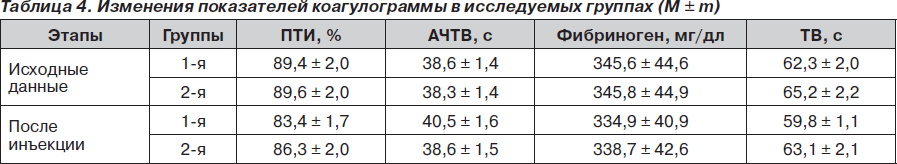
По данным основных показателей коагулограммы, после инъекции низкомолекулярных гепаринов у всех больных отмечали сдвиг в сторону гипокоагуляции, однако без достоверной разницы, что подтверждает селективность НМГ в отношении влияния на IIa-фактор, а преимущественно на Ха-фактор (табл. 4).
Ни в одном из наблюдений в группах больных не отмечалось осложнений геморрагического характера. Таким образом, результаты наших исследований подтверждают имеющиеся данные о том, что интраоперационное повреждение органов и тканей приводит к активации гемостатических механизмов, направленных на остановку кровотечения и репарацию. Однако у пациентов пожилого возраста при сопутствующей патологии операционная травма нарушает баланс между свертывающими и противосвертывающими механизмами, приводя к развитию тромбоэмболических осложнений.
У больных первой группы на фоне применения Цибора® операционная кровопотеря составляла в среднем 342 ± 38 мл, в то время как при применении других низкомолекулярных гепаринов — 480 ± 42 мл. В послеоперационном периоде кровопотеря составляла 150 ± 18 мл (в группе Цибора®) и 180 ± 23 мл (в группе других низкомолекулярных гепаринов). Разница между группами по обоим показателям достоверна (p < 0,05). Применение препаратов донорской крови не потребовалось.
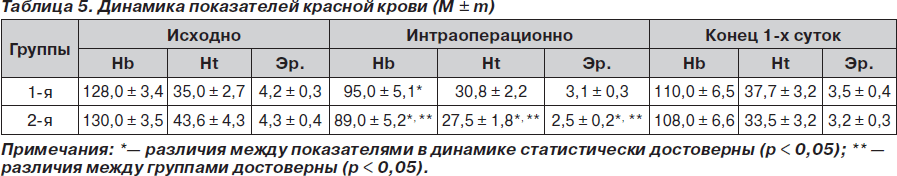
Отмечено достоверное (p < 0,05) снижение показателей Hb, Ht и количества эритроцитов у пациентов обеих групп в интраоперационном периоде к моменту наибольшей кровопотери, что совпадало со временем начала инфузии коллоидных препаратов и являлось следствием управляемой гемодилюции, причем во 2-й группе изменения были более выраженными и имели достоверную разницу с аналогичными показателями в 1-й группе. К концу первых суток наблюдали стабилизацию показателей красной крови в обеих группах на более низких значениях, однако достоверной разницы с исходными не отмечено (табл. 5).
Не отмечено существенных сдвигов биохимических показателей крови во всех группах исследуемых больных. В общем анализе мочи значимых изменений у больных не выявлено. Симптоматических венозных тромбоэмболических осложнений не отмечено ни в одной из групп.
Анализ затрат при тромбопрофилактике Цибором® показал, что применение его в качестве лекарственного профилактического средства 1-й линии эффективнее и выгоднее по сравнению с другими НМГ за счет послеоперационного старта.
Выводы
1. Оптимальным методом тромбопрофилактики при выполнении ортопедических операций с использованием нейроаксиальной блокады является послеоперационный старт.
2. Послеоперационный старт тромбопрофилактики с применением бемипарина (препарат Цибор®) при выполнении ортопедических оперативных вмешательств является таким же эффективным, как и дооперационный с применением других НМГ, а также способствует снижению интраоперационной кровопотери и кровопотери по дренажам в послеоперационном периоде.
3. Послеоперационный старт тромбопрофилактики снижает риск спинальных гематом при проведении нейроаксиальной блокады.
Бокарев И.Н., Попова Л.В., Кондратьев Т.Б. Венозный тромбоэмболизм: лечение и профилактика // Consilium Medicum. Хирургия. — 2005. — 7. — 1.
Дзяк Г.В., Клигуненко Е.Н., Снисарь В.И. Фракционированные и нефракционированные гепарины в интенсивной терапии. — Москва: Медпресс-информ, 2005.
Загородний Н.В. Профилактика тромбоэмболических осложнений у ортопедических больных при эндопротезировании крупных суставов. Материалы городского симпозиума «Профилактика тромбоэмболических осложнений в травматологии и ортопедии». — Москва, 2003. — 34.
Кондратьева Т.Б., Макаров В.А. Применение гепаринов в клинической практике. C интернет-сайта InteLabs: Copyright Русский медицинский журнал, 2006–2007.
Яковлев В.Б. Тромбоэмболия легочной артерии. Диагностика, лечение, профилактика // Рус. мед. журн. — 1998. — 6. — 16.
Гужевський І.В., Герасименко С.І., Циба А.М. Часто- та тромбозів глибоких вен нижніх кінцівок після тотального ендопротезування кульшових суглобів при застосуванні низькомолекулярних гепаринів // Травма. — 2009. — Т. 10, № 4. — С. 435-439.
Bergqvist D. et al. Low molecular weight heparin once daily compared with conventional low-dose heparin twice daily. A prospective double-blind multicentre trial on prevention of postoperative thrombosis // Br. J. Surg. — 1986. — 73. — 3. — 204-208.
Geerts W.H., Bergqvist D., Pineo G.F. et al. Prevention of Venous Thromboembolism: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition) // Chest. — 2008. — 133. — 381S-453S.
Borrell M., Antonijoan R.M., Ortin R. et al. Pharmacokinetic profiles of two LMWH: Bemiparin 3,500 IU and Enoxaparin 4,000 IU after subcutaneous administration in healthy volunteers // Thromb. Haemost. — 2001. — Vol. 86, Suppl. — CD3578 (Abstract).
Martinez-Gonzales J., Vila L., Rodriguez C. Bemiparin: second-generation, low-molecular-weight heparin for treatment and prophylaxis of venous tromboembolism // Expert Review of Cardiovascular Therapy. — 2008. — Vol. 6, № 6. — P. 793-802.