Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Место антагонистов альдостерона в лечении сердечно-сосудистых заболеваний: сегодня и завтра
Авторы: А.Э. Багрий, д.м.н., профессор, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней, общей практики и семейной медицины
Версия для печати
Альдостерон является минералокортикоидом, продуцируемым в zona glomerulosa коры надпочечников. В течение последних лет показана также возможность его образования в экстраадренальных тканях, в т.ч. в структурах стенки сосуда и миокарда. Секреция альдостерона контролируется рядом биологических систем, ведущее место среди которых занимает ренин-ангиотензиновая (при ее активации образование альдостерона возрастает); кроме того, в регуляции формирования альдостерона принимают участие системы натрийуретических гормонов, допамина, адренокортикотропного гормона, симпатическая система. Важную роль в контроле темпов секреции альдостерона играют уровни калиемии: даже при небольшом увеличении содержания калия в сыворотке существенно возрастает секреция альдостерона.
Влияние альдостерона на водно-электролитный баланс. Благодаря своим эффектам на структуры нефрона альдостерон является важнейшим фактором поддержания водно-электролитного баланса в организме (в первую очередь внутриклеточного объема жидкости и метаболизма калия). В главных клетках, расположенных в дистальных извитых канальцах и в начальном отделе собирательных трубок, альдостерон способствует увеличению реабсорбции ионов натрия. Это приводит к изменению электрохимического градиента между просветом канальца и клеточным цитозолем, что вызывает увеличение диффузии ионов калия и водорода в просвет канальца, возрастание их выведения из организма.
Влияние альдостерона на процессы коллагенообразования. В течение последних 15 лет были установлены и достаточно подробно изучены также рост-стимулирующие эффекты альдостерона на фибробласты (вызывающие их пролиферацию и увеличивающие темпы образования коллагена). Были представлены данные о том, что при длительном (более 3 недель) устойчивом увеличении уровней альдостерона в циркуляции происходит значительное ускорение пролиферации фибробластов с выраженной стимуляцией процессов периваскулярного фиброзирования (включая как крупные, так и средние и мелкие сосуды, в том числе интрамиокардиальные — в предсердиях и желудочках, и другие интраорганные).
Другие эффекты альдостерона на сердечно-сосудистую систему. За последние годы представлены данные о наличии у альдостерона целого комплекса неблагоприятных сердечно-сосудистых (СС) эффектов (о части из них пока известно только из экспериментальных работ на животных).
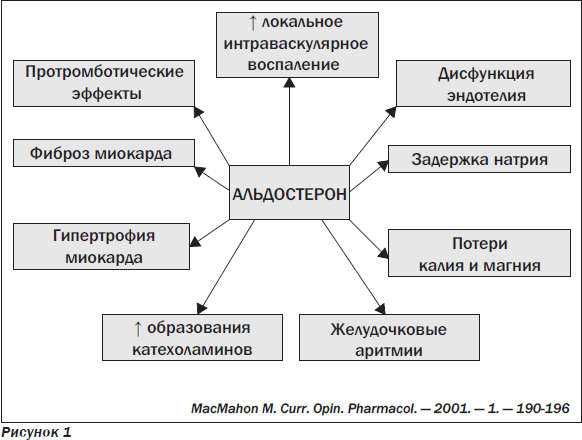
Неблагоприятные эффекты альдостерона на сердечно-сосудистую систему (адаптировано из J.N. Cohn, W. Colucci, 2006):
— увеличение (↑) локального интраваскулярного воспаления;
— ↑ синтеза коллагена фибробластами миокарда;
— ↑ ишемии и некроза миокарда (продемонстрировано в экспериментальных моделях на животных);
— ↑ уровней ингибитора активатора плазминогена (PAI-1);
— снижение (↓) барорефлекторной чувствительности;
— блокирование захвата норадреналина миокардом (продемонстрировано в экспериментальных моделях на животных), ухудшение параметров вариабельности сердечного ритма, ↑ риска катехоламин-индуцированных аритмий;
— ↑ апоптоза миокардиоцитов (продемонстрировано в экспериментальных моделях на животных);
— ↑ электрического ремоделирования миокарда (сердечная недостаточность (СН), постинфарктные больные).
В настоящее время альдостерон рассматривается как один из важных нейрогуморальных факторов развития так называемого электрического ремоделирования миокарда у больных с хронической сердечной недостаточностью (ХСН) и у постинфарктных пациентов; показано, что он способствует развитию у этих больных нарушений реполяризации и изменениям функции ионных каналов мембраны миокардиоцитов. У больных с острым инфарктом миокарда (ОИМ) этот процесс развивается уже на ранних этапах (предшествуя изменениям структуры и функции камеры левого желудочка (ЛЖ)) и является важным механизмом повышения риска возникновения жизнеопасных желудочковых нарушений ритма и внезапной сердечной смерти (рис. 1).
Взаимодействие альдостерона с рецепторами. Рецепторы альдостерона представляют собой специализированные протеиновые структуры, расположенные на мембране или внутри клеток дистальных извитых канальцев нефрона, фибробластах и, возможно, некоторых других. В настоящее время выделяют два основных варианта действия альдостерона на клетки, обладающие рецепторами к нему (клетки-мишени). Первый из них, так называемый геномный (genomic), связан с действием альдостерона на внутриклеточные рецепторы, приводит к транскрипции ДНК и трансляции эффекторных протеинов; развитие эффекта при этом отсрочено на часы/дни. Второй механизм обозначается как негеномный (nongenomic), он опосредован влиянием альдостерона на мембранные рецепторы (отличающиеся по структуре и функциям от внутриклеточных), этот процесс не требует участия информационной РНК и синтеза белков; развитие эффекта при этом быстрое, в течение нескольких минут после взаимодействия альдостерона с рецептором. Влияние альдостерона на процессы фиброзирования миокарда, как полагают, реализуется в большей степени через геномный вариант взаимодействия с рецепторами; в то же время эффекты альдостерона на электрическое ремоделирование миокарда, скорее, связаны с негеномными механизмами. Показано, что антагонисты рецепторов альдостерона блокируют как внутриклеточные, так и мембранные рецепторы; особенности этого блокирования остаются предметом изучения (представлены данные о том, что спиронолактон блокирует лишь геномные эффекты альдостерона, а эплеренон — как геномные, так и негеномные его эффекты).
Роль альдостерона при постинфарктном ремоделировании ЛЖ. У больных с ОИМ, а также у постинфарктных пациентов представлены доказательства как прямого, так и косвенного стимулирующего влияния альдостерона на процессы локального интраваскулярного воспаления в структурах миокарда, интрамиокардиального фиброзирования. Показано, что альдостерон может синтезироваться непосредственно в миокарде. В исследованиях с непосредственным измерением концентраций альдостерона в плазме крови, полученной из корня аорты и из коронарного синуса при катетеризации больных в острой фазе ИМ, показана активация процесса синтеза альдостерона в миокарде, с увеличением активности фермента кардиальной альдостероновой синтетазы (синтазы) и со значительным (почти четырехкратным) возрастанием уровней альдостерона. В настоящее время альдостерон рассматривается в качестве одного из ведущих нейрогуморальных факторов, способствующих увеличению содержания коллагена в миокарде, повышению темпов постинфарктного ремоделирования ЛЖ, развитию его дилатации и деформации (сферизации), снижению его глобальной и региональной систолической и диастолической функций, стимулированию апоптоза миокардиоцитов, усугублению дисфункции эндотелия, усилению локального интраваскулярного воспаления и интраваскулярного тромбозирования, повышению риска возникновения аритмий. По мнению ряда экспертов (J.N. Cohn, W. Colucci, 2006), многие из патофизиологических процессов в ходе постинфарктного ремоделирования ЛЖ связаны не с эффектами ангиотензина II, как считалось ранее, но с эффектами альдостерона.
Клиническая значимость СН у больных с ОИМ. Снижение фракции выброса (ФВ) ЛЖ ≤ 45 % и/или клинические признаки СН в ранний период после ОИМ связаны с высокой частотой смертельных исходов и госпитализации по поводу СН. Согласно данным регистра VALIANT (VALsartan In Acute Myocardial Infarction Trial), клинические проявления СН на начальных этапах ОИМ существенно ухудшают прогноз у пациентов, а выраженность СН прямо коррелирует с уровнем госпитальной смертности. Так, у пациентов с СН ІІ и выше функционального класса (ФК) по Killip и ФВ ЛЖ сердца > 40 % риск смерти составляет 7,7 %, а при сочетании СН ІІ и выше ФК по Killip и ФВ ЛЖ ≤ 40 % риск возрастает до 13 %.
Антагонисты альдостерона (эплеренон) у больных с ОИМ. Известно, что высокий уровень альдостерона в крови у пациентов с ОИМ при госпитализации в стационар является одним из независимых факторов риска смерти (Beiguy, 2006). Патогенетическая роль альдостерона в развитии постинфарктного ремоделирования ЛЖ и прогрессировании СН определяет большое значение антагонистов альдостерона в их лечении.
Благоприятные эффекты блокирования рецепторов альдостерона на сердечно-сосудистую систему — кардио- и вазопротекция (адаптировано из J.N. Cohn, W. Colucci, 2006):
1. Продемонстрированы в экспериментальных работах:
— ↑ NO-зависимой вазодилатации;
— ↓ образования супероксида;
— ↓ синтеза коллагена фибробластами;
— ↓ апоптоза миокардиоцитов;
— ↓ активации тромбоцитов;
— ↓ депонирования коллагена в неинфарцированных областях миокарда, ↓ интерстициального фиброзирования миокарда;
— ↓ напряжения стенок левого желудочка;
— ↓ уровней норадреналина в плазме;
— ↓ электрического ремоделирования миокарда после ОИМ.
2. Продемонстрированы в клинических исследованиях:
— ↑ биодоступности оксида азота;
— ↓ уровней проколлагена III типа (маркера сосудистого фиброзирования);
— ↓ реактивного интерстициального фиброза миокарда; отсутствие неблагоприятного влияния на растяжение (expansion) участка некроза при ИМ, репаративный (заместительный) фиброз, эффективность формирования рубца;
— ↓ массы миокарда, объемов ЛЖ (при артериальной гипертензии, у постинфарктных больных);
— ↑ захвата норадреналина миокардом, улучшение параметров вариабельности сердечного ритма, особенно в утренние часы, ↓ риска аритмий;
— ↑ барорефлекторной чувствительности;
— ↑ систолической функции левого желудочка у постинфарктных больных;
— ↑ диастолической функции левого желудочка;
— ↓ общей смертности, частоты госпитализаций и риска внезапной сердечной смерти — для больных с тяжелой ХСН III–IV функциональных классов (спиронолактон — RALES);
— ↓ риска общей, сердечно-сосудистой смерти, внезапной сердечной смерти, повторных госпитализаций — для постинфарктных больных с систолической дисфункцией левого желудочка и клиническими проявлениями ХСН (Инспра — EPHESUS).
К настоящему времени накоплены данные о том, что эффективная блокада альдостерона в ранние сроки после ОИМ (в дополнение к стандартной терапии) может благоприятно влиять на процесс ремоделирования ЛЖ и существенно улучшать прогноз пациентов, перенесших ОИМ и имеющих систолическую дисфункцию ЛЖ и/или симптомы СН. В исследовании M. Hayashi (2003) было показано, что ранняя блокада рецепторов альдостерона эффективно предотвращает формирование коллагена в миокарде и развитие дилатации ЛЖ сердца при переднем ОИМ.
Способность селективного антагониста альдостерона эплеренона (Инспра) существенно улучшать прогноз пациентов данной категории была доказана в ходе двойного слепого плацебо-контролируемого исследования EPHESUS (Eplerenone Post-Acute Myocardial Infarction Heart Failure Efficacy and Survival Study). Целью этого исследования было изучение влияния эплеренона на общую, СС-смертность и частоту госпитализаций, связанных с СС-причинами (СН, повторный ИМ, инсульт и желудочковые аритмии), у больных с ОИМ.
В исследовании приняли участие 6632 пациента (средний возраст 64 года) с ОИМ, осложненным систолической дисфункцией ЛЖ (ФВ < 40 %) и клиническими признаками СН (в том числе транзиторными). Приблизительно у 90 % больных обеих групп наблюдались клинические признаки СН, а у 65 % пациентов на момент рандомизации отмечались признаки СН II ФК по Killip. Продолжительность наблюдения составила в среднем 16 мес.
На 3–14-й день после перенесенного ОИМ пациентов рандомизировали в группы лечения эплереноном или плацебо. Большинство пациентов получали стандартную терапию при ОИМ, осложненном систолической дисфункцией ЛЖ: 87 % больных принимали ингибиторы АПФ или БРА; 75 % — бета-адреноблокаторы; 60 % — диуретики; 88 % — ацетилсалициловую кислоту и 47 % — статины. 45 % участникам обеих групп была проведена коронарная реперфузия. В течение первых 30 дней лечения эплеренон назначали в дозе 25 мг/сут с последующей титрацией через 4 нед. до 50 мг/сут (при уровне калия в сыворотке крови < 5,0 ммоль/л).
Результаты анализа данных EPHESUS, полученные уже за первые 30 дней, позволяют высоко оценить способность эплеренона снижать раннюю смертность после ОИМ. Так, согласно полученным данным, применение эплеренона способствовало существенному снижению общей смертности (на 31 %) по сравнению с плацебо. Риск СС-смерти снизился на 32 %, риск внезапной смерти — на 37 %.
Относительный риск госпитализации по поводу СН уменьшился на 18 %. Особенно выраженный эффект применения эплеренона в раннем постинфарктном периоде был отмечен в подгруппе наиболее тяжелых пациентов — с ФВ ≤ 30 %. У таких больных риск смерти от всех причин снизился на 43 %, СС-смерти — на 44 %, внезапной смерти — на 58 % по сравнению с плацебо.
Выраженное снижение риска внезапной смерти (до 59 %) наблюдалось и в популяции пациентов, получавших эплеренон в дополнение к комплексной терапии ингибиторами АПФ, бета-адреноблокаторами, ацетилсалициловой кислотой и статинами.
Проведенный анализ подтверждает, что применение эплеренона даже в низкой дозе (25 мг/сут) обеспечивает существенное снижение СС-смертности и заболеваемости в течение первых 30 дней с момента развития ОИМ. Это тем более важно, если учесть, что 25 % всех смертей, зарегистрированных на протяжении среднего периода наблюдения в динамике 16 мес. в группе плацебо, наступили в течение первых 30 дней после рандомизации.
Дальнейший прием эплеренона больными с ОИМ и СН на протяжении 16 мес. наблюдения обеспечил снижение общей смертности на 15 %, комбинированного показателя СС-смертности и госпитализаций по причине ССЗ — на 13 %. Риск внезапной смерти в группе пациентов, принимавших этот препарат, снизился на 21 %, госпитализаций по поводу СН — на 15 %.
Заслуживают внимания и данные ретроспективного анализа, проведенного в популяции больных сахарным диабетом (СД), который рассматривали в качестве самостоятельного критерия включения пациентов в исследование EРНESUS. СД имели 22 % участников исследования, средняя доза эплеренона у этих пациентов составила 43 мг/сут. Применение эплеренона у пациентов с СД и признаками СН в исследовании способствовало снижению риска развития комбинированной конечной точки (СС-смертность + госпитализация по поводу ССЗ) на 17 % по сравнению с плацебо. При этом в группе больных СД наблюдалось более выраженное снижение абсолютного риска по сравнению с пациентами без СД (5 % против 3 %). Осложнения ССЗ у пациентов с СД, принимавших эплеренон, развились в 28 % случаев, тогда как в группе плацебо — в 35 %.
В целом анализ данных исследования EРНESUS свидетельствует о том, что раннее назначение эплеренона способствует значительному улучшению как краткосрочных (в течение 30 дней), так и долгосрочных (на протяжении 16 мес.) исходов для больных, а также значительному снижению уровня общей, сердечно-сосудистой и внезапной смертности.
После получения результатов исследования EРНESUS, в котором препарат эплеренон назначали на 3-и–14-е сутки после ОИМ, возник вопрос о целесообразности и безопасности еще более раннего (в первые 24 ч после развития ОИМ) применения препарата. При этом обсуждалась проблема возможного отрицательного влияния эплеренона на процесс организации рубца в миокарде и повышение риска разрыва миокарда. Однако к настоящему времени получены данные экспериментальных исследований, в которых доказана безопасность использования этого препарата после ОИМ в первые 24 ч. В частности, доказано, что эплеренон не влияет на процессы формирования постинфарктного рубца и повышает активность фактора XIII, дефицит которого увеличивает риск разрыва миокарда (Fraccarolo, Bauersachs, 2007).
В экспериментальных исследованиях, проведенных Fraccarolo и Bauersachs в 2003 г., показано потенцирование эффектов ингибитора АПФ и эплеренона при использовании у пациентов с обширным ИМ: сочетанное применение этих препаратов способствовало уменьшению конечного диастолического объема ЛЖ и влияло на характер продуцируемого коллагена. Кроме того, установлено, что блокада минералокортикоидных рецепторов с помощью эплеренона сразу после ОИМ способствует повышению плотности капилляров и увеличению пролиферации эндогенных клеток-предшественников из моноцитов (Fracarollo, Bauersachs, 2007).
В эксперименте наблюдалось также улучшение эндотелиальной функции и снижение продукции одного из сосудосуживающих факторов — супероксид аниона — при использовании эплеренона в ранние сроки после ОИМ (Sartorio, Fraccarolo, 2005).
Не менее важным преимуществом эплеренона является профилактическое действие препарата в плане возникновения желудочковых аритмий. В настоящее время имеются данные о том, что гиперэкспрессия минералокортикоидных рецепторов миокардом способствует развитию желудочковых аритмий (F. Jaisser, 2005). В связи с этим сегодня в терапии пациентов с нарушениями ритма сердца антагонисты альдостерона рассматривают в качестве важного компонента так называемой адъювантной патогенетической терапии, широко применяя их в дополнение к антиаритмическим препаратам. Механизм действия антагонистов альдостерона при нарушениях ритма сегодня не до конца изучен. Предположительно, эти препараты оказывают опосредованное антиаритмическое действие через улучшение механической функции сердца.
Результаты недавних экспериментальных исследований показали, что эплеренон ослабляет ремоделирование предсердий и предотвращает индукцию мерцательной аритмии при СН путем влияния на такие параметры, как уровень давления крови в левом предсердии (ЛП), индекс площади ЛП, фракция укорочения ЛП, средняя длительность эпизода мерцательной аритмии, активность металлопротеиназ (G. Moe, A. Koinig et al., 2009).
Результаты исследования EРНESUS с применением эплеренона и более раннего исследования RALES с применением другого антагониста альдостерона — спиронолактона — в лечении пациентов с застойной СН способствовали расширению показаний к применению этих препаратов: сегодня антагонисты альдостерона находят достаточно широкое использование в лечении больных с СН. При этом британские эксперты подчеркивают, что эффективность в отношении снижения смертности при применении в ранние сроки у пациентов, перенесших ОИМ и имеющих систолическую дисфункцию ЛЖ сердца и/или симптомы ХСН, доказана только для эплеренона, тогда как для спиронолактона такие данные на сегодня отсутствуют. Кроме того, в американских рекомендациях 2007 г. по лечению АГ и ИБС указано, что антагонисты альдостерона эффективны в снижении артериального давления и могут использоваться в комбинированной антигипертензивной терапии для улучшения прогноза у пациентов с АГ и ИБС.
Применение эплеренона при АГ. Представляет интерес возможность использования антагонистов альдостерона (в частности, эплеренона) у лиц с АГ (в первую очередь, имеющих гиперальдостеронизм). Показано, что при АГ 2-й степени распространенность гиперальдостеронизма достигает 8 %, при АГ 3-й степени — 13 %, а при резистентной АГ (требующей применения эффективных доз ≥ 4 антигипертензивных препаратов для достижения целевых цифр АД) — 20 % (L. Mosso et al., 2003; P.A. Calhoun et al., 2002). Гиперальдостеронизм является одной из наиболее частых причин симптоматической АГ и частой причиной резистентной АГ. К настоящему времени эплеренон располагает данным 14 клинических исследований применения при АГ (в том числе у больных с резистентной АГ, АГ 3-й степени, с гиперальдостеронизмом); он зарегистрирован в качестве препарата для лечения таких пациентов в США, странах Европы, а также в Украине.
Выбор антагониста альдостерона. Ниже представлены данные о преимуществах эплеренона по сравнению со спиронолактоном.
Преимущества эплеренона в сравнении со спиронолактоном:
— способность блокировать все негативные эффекты альдостерона, в том числе и быстрые, негеномные (в отличие от спиронолактона, блокирующего только медленные, геномные эффекты);
— отсутствие побочных эффектов, связанных с влиянием на половые гормоны (гинекомастия и импотенция у мужчин, нарушения менструального цикла и боль в молочных железах у женщин);
— отсутствие антиандрогенового действия (сниженные уровни андрогенов недавно продемонстрированы в качестве независимого фактора риска неблагоприятного сердечно-сосудистого прогноза у больных с СН обоих полов (Р. Piotrowsky et al., 2009));
— отсутствие активных метаболитов;
— слабая связь с белками;
— более мягкая и устойчивая блокада минералокортикоидных рецепторов;
— быстрое наступление действия (является активным веществом в отличие от пролекарства спиронолактона);
— более высокая электролитная безопасность (реже вызывает гиперкалиемию по сравнению со спиронолактоном);
— отсутствие взаимодействия с дигоксином;
— однократный прием в течение суток.
В соответствии с данными доказательной медицины, показания к применению спиронолактона и эплеренона несколько отличаются, несмотря на их принадлежность к одному классу препаратов. Основными показаниями к назначению спиронолактона являются первичный гиперальдостеронизм, отечные состояния у пациентов с застойной СН, циррозом, нефротическим синдромом, а также эссенциальная гипертензия. Эплеренон применяется с целью улучшения прогноза у постинфарктных пациентов с систолической дисфункцией ЛЖ и/или клиническими признаками СН. Кроме того, этот препарат показан для применения в комплексном лечении АГ.
Побочные эффекты эплеренона. К основным побочным эффектам эплеренона относят гиперкалиемию и повышение уровня креатинина в сыворотке крови. В связи с этим в процессе лечения эплереноном рекомендуется рутинное измерение этих показателей. В случаях назначения эплеренона в острой фазе ИМ при отсутствии данных об уровне креатинина и калия в сыворотке крови,необходимо провести биохимическое исследование через 48 ч после начала терапии. В европейских руководствах рекомендуется проводить контроль этих показателей по истечении 1-й и 4-й недели терапии и через 3 мес. приема препарата, а также через неделю после каждого изменения дозы. При повышении уровня калия в крови возможно назначение более низких доз эплеренона, эффективность которых была показана в исследовании EPHESUS.
Подытоживая приведенную информацию, можно говорить о существенном расширении на современном этапе показаний к применению эплеренона и о перспективах его использования в лечении разных категорий кардиологических больных.
