Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Сучасні антиаритмічні препарати: практичні аспекти застосування
Авторы: А.В. Ягенський, д.м.н., професор кафедри сімейної медицини, Львівського національного медичного університету ім. Данила Галицького
Версия для печати
На сьогодні спектр препаратів, що можуть застосовуватися в лікуванні порушень ритму, досить широкий. Утім через істотний ризик кардіальних та некардіальних побічних ефектів їх застосування обмежене. Триває пошук нових препаратів у надії знайти «ідеальний» антиаритмік, що був би достатньо ефективним при різних порушеннях ритму і, що найголовніше, максимально безпечним. Однак істотних зрушень за останнє десятиріччя в цьому напрямку практично немає. Єдиним винятком можна вважати лише запровадження дронедарону, що великою мірою змінило підходи до лікування фібриляції передсердь (ФП).
Поділ антиаритмічних препаратів грунтується на їх електрофізіологічних властивостях. Необхідно усвідомлювати, що будь-яка класифікація антиаритмічних препаратів приречена на обмеження. Це пов’язано з цілим рядом проблем. По-перше, більшість класифікацій грунтуються на механізмові дії препарату на рівні ізольованої клітини. Як впливає препарат на електрофізіологічні властивості клітин у реальній ситуації, особливо при різних патологічних станах, поки точно невідомо. По-друге, більшість препаратів взаємодіють не з одним типом іонних каналів. Наприклад, хінідин блокує як натрієві, так і калієві канали. По-третє, механізми виникнення багатьох порушень ритму ще не відомі.
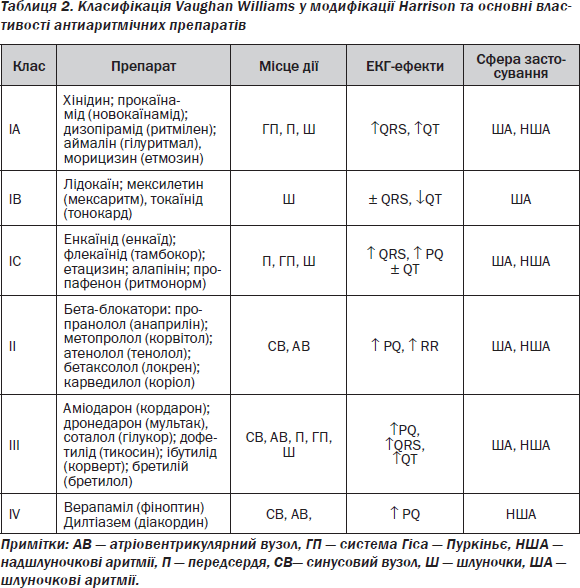
Тому існує декілька класифікацій антиаритмічних препаратів. У 1990 році групою експертів Європи, які зібралися на Сицилії, була запропонована класифікація під оригінальною назвою «Сицилійський гамбіт». Експерти врахували багато особливостей дії антиаритмічних препаратів, новi данi експериментальних досліджень. Класифікація досить детально описує властивості окремих препаратів у вигляді схеми, що наводиться в табл. 1. Утім «Сицилійський гамбiт» є надто складною класифікацією. Тому і в науковій літературі, і в практичній кардіології найбільш часто користуються класифікацією Vaughan Williams у модифікації Harrison. Хоча вона не враховує багатьох моментів, завдяки простоті її широко застосовують уже понад 30 років.
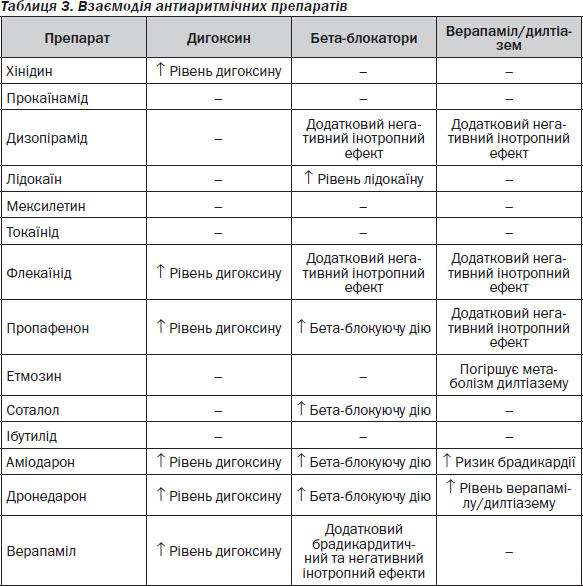
За Vaughan Williams, антиаритмiчнi препарати поділяються на чотири основних класи (табл. 2). І клас становлять препарати, що блокують натрієві канали. Залежно від кінетики взаємодії з натрієвими каналами І клас поділено на три підкласи. ІА підклас (хінідин, прокаїнамід, дизопірамід) за кінетикою займає проміжне місце. Препарати ІВ підкласу мають швидку кінетику: вони швидко взаємодіють із рецепторами, але так само швидко від’єднуються від них. У цей підклас входять лідокаїн, мексилетин та токаїнід. Нарешті, препарати ІС підкласу (енкаїнід, флекаїнід, пропафенон, етацизин, алапінін) повільно взаємодіють із рецепторами та мають здатність накопичуватися в каналах. Клас ІІ становлять бета-блокатори. Основний механізм їх дії — блокада бета-адренергічних рецепторів. Препарати ІІІ класу блокують калієві канали. Препарати ІV класу блокують кальцієві канали.
З практичної точки зору важливо те, на які порушення ритму діють препарати. Умовно їх можна розділити на препарати вузького спектра, які впливають в основному на надшлуночкові (IV клас) чи шлуночкові (ІВ клас) аритмії, та широкого спектра, що застосовуються в лікуванні як шлуночкових, так і надшлуночкових порушень ритму (більшість інших антиаритмічних препаратів).
ІА клас
Препарати цього класу ефективні в лікуванні більшості порушень ритму. Ефективність у хворих з екстрасистолією становить 50–70 %, при надшлуночкових тахікардіях — 30–60 %, при шлуночкових тахікардіях — 20–40 %, при ФП — 40–60 %.
Безпосередня дія препаратів ІА класу на провідну систему серця полягає у сповільненні проведення по передсердях, атріовентрикулярному (АВ) вузлу, системі Гіса — Пуркіньє (табл. 2). Однак властивий усім цим препаратам холінолітичний ефект, як правило, перекриває їх пряму дію. У результаті реєструється підвищення частоти серцевих скорочень (ЧСС) та покращення проведення по АВ-вузлу в більшості пацієнтів. Останнє особливо важливо у хворих із ФП — препарати ІА класу можуть значно збільшувати ЧСС. Поєднання сповільненого проведення по передсердях із покращенням АВ-провідності в пацієнтів із тріпотінням передсердь може призвести до проведення кожного імпульсу з передсердь до шлуночків (1 : 1) з частотою скорочення шлуночків до 300 уд/хв. Особливо виражений холінолітичний ефект у дизопіраміду, застосування якого часто супроводжується не лише вказаними кардіальними ефектами, а й сухістю в роті, порушенням зору, погіршенням сечовипускання.
Вплив препаратів ІА класу на ЕКГ полягає в розширенні комплексу QRS та подовженні інтервалу QT. Із подовженням інтервалу QT асоціюється найбільш небезпечне ускладнення терапії препаратами ІА класу — поява шлуночкової тахікардії типу пірует (torsades de pointes), що може переходити у фібриляцію шлуночків. Найчастіше це ускладнення виникає при застосуванні хінідину — в 1–3 % хворих (класичні хінідинові синкопе), дещо рідше у пацієнтів, які отримують прокаїнамід чи дизопірамід. Ризик тахікардії типу пірует найбільший у хворих із початковим подовженням інтервалу QT, брадикардією, гіпокаліємією та на тлі прийому серцевих глікозидів чи препаратів ІІІ класу. Тому препарати ІА класу відміняють при подовженні інтервалу QT більше ніж на 25 %. Розширення комплексу QRS більше ніж на 50 % також потребує відміни препарату, оскільки свідчить про надмірне сповільнення проведення. При застосуванні хінідину, дизопіраміду необхідно враховувати також їх можливу взаємодію з іншими антиаритмічними препаратами (табл. 3).
Типовою для препаратів ІА класу є відносно висока частота некардіальних побічних ефектів, що виникають у 15–35 % хворих. Найчастіше реєструються нудота, пронос, гіпотонія, запаморочення, указані вище атропіноподібні ефекти. Крім того, при тривалому прийомі прокаїнаміду у 20–30 % хворих виникає вівчакоподібний синдром. Ще одним недоліком цих препаратів є короткий період напіввиведення, що зумовлює необхідність частого прийому протягом доби.
Останнім часом препарати ІА класу все рідше застосовуються в клінічній практиці. Це обумовлено високою частотою побічних кардіальних та некардіальних ефектів, а також появою більш ефективних підходів до лікування аритмій. Однак найбільш істотною причиною зниження їх популярності є вплив на прогноз хворих з аритміями. У декількох дослідженнях препарати ІА класу виявилися неспроможними покращити прогноз хворих із шлуночковими порушеннями ритму. Більше того, метааналіз застосування хінідину в пацієнтів із ФП виявив значне збільшення смертності серед пацієнтів, які отримували хінідин, порівняно з групою плацебо.
ІВ клас
Препарати ІВ класу відрізняються вузькістю антиаритмічного спектра. Вони діють лише на шлуночкові порушення ритму. Лідокаїн існує лише в ін’єкційній формі й застосовується для припинення шлуночкової тахікардії. Внутрішньовенне введення препарату дозволяє припинити тахікардію у 40–55 % хворих. Особливістю препарату є короткий період дії — терапевтична концентрація в крові утримується до 20–30 хвилин після внутрішньовенного введення та до 1,5–2 годин при внутрішньом’язовому застосуванні. Отже, оптимальним шляхом підтримання терапевтичної концентрації лідокаїну є його тривала інфузія. З іншого боку, короткий період напіввиведення дозволяє досить швидко вводити інші препарати при неефективності лідокаїну.
Основні побічні ефекти при застосуванні лідокаїну пов’язані з його впливом на центральну нервову систему (сонливість, парестезії, ейфорія, судороги). Найчастіше такі явища спостерігаються при надто швидкому введенні препарату, особливо в осіб старшого віку. Тому болюсно вводити лідокаїн необхідно відносно повільно — протягом 7–10 хвилин.
Інші препарати ІВ класу застосовуються перорально. Основна сфера застосування — профілактика шлуночкових порушень ритму. Найчастіше застосовується мексилетин. Однак відносно короткий період напіввиведення, який вимагає трьох-/чотирьохразового прийому та розвиток ускладнень із боку центральної нервової системи та шлунково-кишкового тракту майже у третини хворих обмежує широке використання препарату.
Ризик аритмогенного ефекту при застосуванні препаратів ІВ класу відносно невисокий — 5–10 %. У терапевтичних дозах вони не впливають на тривалість інтервалів PQ та QT та ширину комплексу QRS.
ІС клас
Характерною особливістю цього класу препаратів є висока антиаритмічна активність як при шлуночкових, так і при надшлуночкових аритміях, що часто перевищує 70 %. Некардіальні сторонні ефекти реєструються відносно рідко (до 10 % випадків). Таке вдале поєднання викликало великий ентузіазм у 80-х роках XX ст. та призвело до створення великої кількості препаратів ІС підкласу, у тому числі в СРСР (етацизин, алапінін, бонекор). Проте на сьогодні застосування цих препаратів значно обмежене. Основна причина — виражений проаритмічний ефект, що вважається відповідальним за зростання смертності, наприклад при лікуванні шлуночкових порушень ритму у хворих після інфаркту міокарда.
Основними предикторами аритмогенної дії та ризику раптової смерті є наявність вираженої структурної патології серця. Тому прийом препаратів ІС класу можливий лише в пацієнтів із відсутністю дилатації, гіпертрофії чи рубцевих змін.
Основною сферою застосування препаратів ІС класу на сьогодні є відновлення синусового ритму при ФП та попередження надшлуночкових тахіаритмій при відсутності значних структурних змін у серці. Препарати значно подовжують тривалість QRS, дещо менше — тривалість PQ і майже не впливають на інтервал QT.
Найбільш широко у вітчизняній практиці застосовуються етацизин та пропафенон. Особливістю останнього є наявність слабких бета-блокуючих властивостей. Тому поки що не зовсім ясно, чи має пропафенон при тривалому прийомі таку ж аритмогенну дію, як інші препарати ІС класу. Побічні ефекти при застосуванні пропафенону виникають відносно нечасто, як правило, при застосуванні високих доз (понад 900 мг/добу). Крім аритмогенної дії, що реєструється у 5–13 % хворих, найчастіше реєструються неврологічні (запаморочення, атаксія, парестезії) та гастроінтестинальні (нудота, блювота, запор) побічні ефекти.
ІІ клас (бета-блокатори)
Бета-блокатори обмежують вплив катехоламінів на трансмембранні потоки кальцію та натрію. У результаті блокада бета-адренергічних рецепторів у серці супроводжується зменшенням кількості внутрішньоклітинного кальцію та зміною його кінетики. Вважається, що саме ці електрофізіологічні зміни можуть зменшувати ризик аритмії. Крім того, бета-блокатори сповільнюють фазу 4-го потенціалу дії і таким чином зменшують частоту імпульсів, що формуються в синусовому та атріовентрикулярному вузлах.
З останнім механізмом у першу чергу пов’язане й застосування бета-блокаторів як антиаритмічних препаратів. Основна сфера їх застосування в аритмології — зниження ЧСС при ФП та синусовій тахікардії. Крім того, препарати можуть використовуватись для припинення АВ-реципрокних тахікардій.
Бета-блокатори помірно ефективні в попередженні шлуночкових та надшлуночкових порушень ритму. Як правило, їх ефективність не перевищує 50 %. Проте в ситуаціях коли порушення ритму пов’язане з надмірною симпатичною активністю, наприклад при фізичних чи емоційних навантаженнях, бета-блокатори є препаратами вибору.
Незважаючи на відносно невисоку безпосередню антиаритмічну активність щодо шлуночкових порушень ритму, бета-блокатори значно покращують прогноз хворих з інфарктом міокарда як у гострому, так і в постінфарктному періодах. На сьогодні не викликає сумніву і їх позитивний вплив на виживання у хворих із серцевою недостатністю. Серед основних причин зменшення смертності в більшості досліджень є зниження частоти раптової смерті. Звичайно, цей ефект обумовлений не лише антиаритмічними властивостями бета-блокаторів, а і їх нейрогуморальними впливами та антиішемічною дією. Отже, при відсутності протипоказань бета-блокатори повинні обов’язково призначатися хворим з інфарктом міокарда та при серцевій недостатності.
Протипоказання до призначення бета-блокаторів добре відомі: бронхіальна астма, ЧСС менше 50 уд/хв, атріовентрикулярна блокада ІІ–ІІІ ступенів, значні порушення периферійного кровообігу.
ІІІ клас
Основним електрофізіологічним ефектом препаратів ІІІ класу є подовження потенціалу дії на всіх ланках провідної системи. Типовим представником цього класу є аміодарон (кордарон). Препарат із понад сорокарічною історією на сьогодні є найбільш широко застосовуваним в аритмології. Хоча аміодарон віднесений до ІІІ класу антиаритмічних препаратів, він має властивості всіх інших класів. Можливо, саме завдяки цій унікальності аміодарон виявляється не лише найефективнішим антиаритміком при більшості порушень ритму, а й одним із найбільш безпечних препаратів.
Серія досліджень продемонструвала безпечність застосування кордарону при серцевій недостатності та інфаркті міокарда. Тому аміодарон може з успіхом застосовуватися для лікування порушень ритму у хворих із вираженою структурною патологією серця.
Крім лікування шлуночкових аритмій аміодарон широко застосовується для припинення та попередження пароксизмів ФП. Він переважає препарати І класу та соталол за частотою збереження синусового ритму та за часом до виникнення першого пароксизму ФП після кардіоверсії.
Важлива особливість аміодарону — тривалий період напіввиведення. Для досягнення стійкої концентрації препарату в крові інколи необхідно від 1 до 6 місяців. Для прискорення цього процесу застосовуються різні навантажувальні схеми. Призначення тієї чи іншої схеми грунтується більше на теоретичних та емпіричних аргументах, аніж на переконливих доказах. За даними різних джерел, початкова доза препарату коливається від 600 до 4400 (!) мг на добу. При необхідності швидкого досягнення ефекту, наприклад при пароксизмальних тахіаритміях, доза повинна бути вищою. При застосуванні препарату з профілактичною метою насичення може проводитися повільнішим темпом.
Фармакодинамічні особливості аміодарону необхідно враховувати і при його відміні. Терапевтична концентрація після тривалого прийому може утримуватися до місяця. Позитивним аспектом тривалого періоду напіввиведення є те, що препарат може прийматись один раз на добу, а також відсутність проблеми пропущеного прийому.
Підтримуюча доза аміодарону при тривалому прийомі в більшості хворих не повинна перевищувати 200 мг/добу. Саме з тривалим прийомом високих доз аміодарону (400–600 мг/добу) пов’язують відносно велику кількість побічних ефектів. Серед них найбільш серйозним є інтерстиціальний пневмоніт та альвеоліт. Крім того, можуть виникати порушення з боку нервової системи (тремор, порушення сну), шкіри (фоточутливість та дисколоризація), щитоподібної залози (гіпотиреоз, гіпертиреоз) чи шлунково-кишкового тракту (нудота, запори). Тому без крайньої необхідності при тривалому прийомі не варто перевищувати дозу 200 мг/добу. Така невисока доза аміодарону є достатньо ефективною та безпечною.
Необхідно нагадати, що аміодарон посилює дію непрямих антикоагулянтів та підвищує концентрацію дигоксину, прокаїнаміду, фенітоїну, флекаїніду.
Інший представник ІІІ класу соталол також не є чистим препаратом ІІІ класу, оскільки має досить вагомі бета-блокуючі властивості. Таке поєднання обумовлене тим, що соталол, який є на ринку, це суміш d- та l-ізомерів соталолу. Перший ізомер подовжує потенціал дії, другий блокує бета-адренорецептори. Бета-блокуюча дія реєструється вже в малих дозах, тоді як властивості препарату ІІІ класу починають проявлятися при прийомі дози 160 мг/добу та більше. Як і кордарон, соталол подовжує потенціал дії в передсердях і в шлуночках, тому вони приблизно однаково ефективні при шлуночкових та передсердних аритміях.
За ефективністю при шлуночкових порушеннях ритму соталол перевищує хінідин, прокаїнамід, пропафенон. Разом із тим, за результатами дослідження SWORD, застосування d-соталолу у хворих після інфаркту супроводжується зростанням смертності. Хоча йдеться про d-соталол, якому притаманні властивості ІІІ класу, застосовувати доступний на ринку d-, l-соталол у хворих із вираженою структурною патологією серця не рекомендується. Найчастіше препарат використовують для профілактики пароксизмів ФП.
Найбільш серйозним побічним ефектом є шлуночкова тахікардія типу пірует (torsades de pointes) унаслідок подовження інтервалу QT. Цей ефект залежить від дози: при прийомі 80 мг/добу тахікардія практично не виникає, тоді як при прийомі дози 320 мг/добу частота сягає 2 %. Крім того, необхідно враховувати можливість побічних ефектів, характерних для бета-блокаторів.
Висока ефективність препаратів ІІІ класу та безпечність аміодарону спонукали до активної розробки саме препаратів цього класу.
Ібутилід. Препарат подовжує потенціал дії перш за все на рівні передсердь. Застосовується для відновлення синусового ритму у хворих із фібриляцією/тріпотінням передсердь. Ібутилід припиняє пароксизми тріпотіння передсердь, що недавно виникли, у 65–80 % хворих, такі ж пароксизми ФП купіруються у 35–50 % випадків. У цьому плані він ефективніший за прокаїнамід та соталол. Існує лише внутрішньовенна форма препарату. Препарат вводиться внутрішньовенно в дозі 1 мг протягом 10 хв. При необхідності повторна доза 1 мг може бути введена протягом 30 хв. Має короткий період напіввиведення, тому як лікувальний, так і побічний ефекти тривають не більше години.
Основним побічним ефектом препарату є поліморфна шлуночкова тахікардія, що виникає приблизно в 5 % хворих і у 2 % випадків потребує втручання. Чинники, що сприяють появі поліморфної тахікардії: жіноча стать, зниження фракції викиду лівого шлуночка та подовження інтервалу QT. У зв’язку з цим хворі повинні спостерігатися щонайменше протягом чотирьох годин після введення препарату.
Дофетилід за своєю хімічною структурою подібний до соталолу. Препарат подовжує потенціал дії та ефективний рефрактерний період, але не впливає на ЧСС та тривалість комплексу QRS. В окремих дослідженнях виявлена позитивна інотропна дія препарату. Дофетилід удвічі знижує ризик фібриляції шлуночків при експериментальній ішемії та зменшує частоту індукування експериментальної шлуночкової тахікардії. У двох плацебо-контрольованих дослідженнях, проведених у хворих із серцевою недостатністю, препарат не впливав на загальну смертність та частоту аритмічної смерті, однак знижував частоту госпіталізацій із приводу серцевої недостатності. Застосування препарату супроводжується відновленням синусового ритму у 30 % хворих із пароксизмами МА.
Указані препарати, особливо ібутилід, зайняли свою нішу в лікуванні аритмій. У 2010 році у клінічну практику був уведений ще один препарат — дронедарон. Препарат за своєю структурою є похідним аміодарону, але його молекула не містить йоду, що практично усуває ризик побічних впливів на щитоподібну залозу. Крім того, при створенні препарату була додана метансульфонільна група, що значно зменшило ліпофільність препарату та, відповідно, період напіввиведення (до 24 год) за рахунок значного зменшення накопичення у тканинах. Дронедарон метаболізується в печінці та виводиться з калом.
Поява дронедарону істотно змінила підходи до лікування ФП. За результатами дослідження ATHENA, препарат достовірно зменшував частоту госпіталізацій, зумовлених серцево-судинними причинами на 24 %, серцево-судинну смертність — на 21 % та смертність від аритмій — на 45 %. Отже, вперше була доведена здатність антиаритмічного препарату покращувати прогноз у хворих із ФП. З огляду на результати дослідження ATHENA та ряду інших досліджень препарат посів чільне місце в опублікованих нещодавно рекомендаціях Європейського товариства кардіологів із лікування ФП. За цими рекомендаціями, дронедарон є препаратом вибору практично в усіх випадках пароксизмальної/персистуючої ФП за винятком тяжкої серцевої недостатності. Крім тяжкої серцевої недостатності, препарат протипоказаний при наявності АВ-блокади ІІ–ІІІ ст., вираженої брадикардії. Як і інші препарати ІІІ класу, дронедарон може подовжувати інтервал QT та зменшувати ЧСС шляхом впливу на синусовий чи атріовентрикулярний вузол. Останній ефект дронедарону може з успіхом використовуватись для контролю ЧСС у хворих із ФП. У дослідженні ERATO продемонстровано, що дронедарон істотно знижує ЧСС у хворих із ФП як у спокої, так і при навантаженні й може безпечно комбінуватись із бета-блокаторами, антагоністами кальцію та серцевими глікозидами.
Таким чином, можна стверджувати, що запровадження в клінічну практику препарату ІІІ класу дронедарону є найвагомішим здобутком у медикаментозному лікуванні аритмій за останні десятиліття.
IV клас (антагоністи кальцію)
Серед широкої та досить розмаїтої групи антагоністів кальцію в аритмології застосовуються лише верапаміл та дилтіазем. Обидва ці препарати пригнічують транспорт кальцію в клітину через повільні канали клітинної мембрани. Оскільки електрофізіологічні процеси визначаються функціонуванням кальційзалежних каналів перш за все в клітинах синусового та АВ-вузлів, основний вплив препарати здійснюють саме на цих рівнях. Найбільш істотно препарати впливають на АВ-вузол: знижують автоматизм, сповільнюють проведення та підвищують рефрактерність. На електрокардіограмі ці зміни проявляються подовженням інтервалу PQ.
Такі властивості верапамілу та дилтіазему визначають сферу їх застосування. Вони є найбільш ефективним при порушеннях ритму, у генезі яких беруть участь структури АВ-вузла або при яких проведення через АВ-вузол визначає перебіг аритмії. Так, верапаміл є препаратом вибору в купіруванні АВ-реципрокних тахікардій. Ефективність внутрішньовенного введення препарату сягає 95 %. Менш ефективним є препарат при профілактиці пароксизмів тахікардії — зменшити їх кількість вдається в 50–60 % хворих.
Досить вагома роль верапамілу та дилтіазему у зниженні ЧСС при ФП. Обидва препарати самостійно чи в комбінації з серцевими глікозидами дозволяють контролювати ЧСС як у спокої, так і при навантаженнях.
Антагоністи кальцію загалом не відіграють істотної ролі в лікуванні пароксизмальної ФП та шлуночкових порушень ритму. Застосування верапамілу та дилтіазему рідко супроводжується істотними побічними ефектами. Найчастіше це порушення з боку центральної нервової системи (запаморочення, головний біль) та шлунково-кишкового тракту (запори). Препарати протипоказані хворим із синдромом Вольфа — Паркінсона — Уайта та при вираженій серцевій недостатності. Необхідно враховувати взаємодію верапамілу з дигоксином (концентрація останнього може підвищуватись під впливом верапамілу) та з бета-блокаторами (синергізм негативного впливу на скоротливість міокарда та ЧСС).
Крiм антиаритмiчних препаратів, включених до класифікації Vaughan Williams, є цілий ряд медикаментів, що застосовуються в лікуванні порушень ритму. Вони впливають на деякі електрофiзiологiчнi параметри безпосередньо чи опосередковано. До таких препаратів належать серцеві глікозиди, аденозин чи аденозинтрифосфат (АТФ), а також електролiти калiй та магнiй.
Серцеві глікозиди використовуються в кардiологiї понад 200 рокiв. Основною сферою їх застосування впродовж цього часу є серцева недостатнiсть та порушення ритму серця. Дія глiкозидiв на провідну систему серця перш за все обумовлена впливом на вегетативну регуляцію серцевої діяльності. У терапевтичних концентраціях вони підвищують тонус парасимпатичної нервової системи. Безпосередній вплив на клітини провідної системи чи на активність симпатичної вегетативної системи у глiкозидiв незначний. Найбільш значно дія глiкозидiв проявляється на рівні атрiовентрикулярного вузла. Препарати подовжують рефрактернiсть АВ-вузла та сповільнюють проведення в ньому. Враховуючи це, основною сферою їх застосування є порушення ритму, у генезi яких беруть участь структури АВ-вузла або при яких проведення через АВ-вузол визначає перебіг аритмії. До перших відносяться АВ-реципрокнi тахікардії, до других — фібриляція та тріпотання передсердь.
Серцеві глікозиди — препарати вибору для зниження ЧСС при ФП у хворих із серцевою недостатністю, оскільки поєднують здатність контролювати ЧСС із позитивною інотропною дією. Разом з тим зниження ЧСС досягається лише у спокої. При навантаженні симпатичні вегетативні впливи переважають над парасимпатичними й ефект глікозидів значно зменшується. Тому для адекватного контролю ЧСС у спокої та при навантаженні у хворих із ФП рекомендується комбінувати серцеві глікозиди з бета-блокаторами або з верапамілом чи дилтіаземом.
Серед серцевих глiкозидiв найбiльш прийнятним препаратом є дигоксин. Препарат є вiдносно полярним глiкозидом, тобто може застосовуватися як внутрiшньовенно, так i перорально та має оптимальні фармакодинамічні властивості. При неможливостi застосування дигоксину препаратом вибору може бути целанiд.
Протипоказаннями до застосування серцевих глiкозидiв є синдром WPW, оскiльки, як і iншi препарати, що сповiльнюють АВ-проведення, глiкозиди можуть вкорочувати рефрактерний перiод додаткових шляхiв. Крiм того, серцевi глiкозиди протипоказанi при гiпертрофiчнiй кардiомiопатiї: пiдвищення скоротливостi мiокарда може посилювати обструкцiю виносного тракту. Недолiком серцевих глiкозидiв є змiна їх концентрацiї в кровi пiд впливом ряду препаратiв. Кордарон, хiнiдин та верапамiл пiдвищують концентрацiю дигоксину. Тому при їх комбiнованому застосуваннi доза дигоксину повина буди зменшена приблизно вдвiчi.
Аденозинтрифосфат та пов’язаний із ним нуклеотид аденозин відіграють важливу роль не лише в регуляції коронарного кровотоку та сили скорочень міокарда, а й у ряді електрофізіологічних процесів. Найбільш суттєвим електрофізіологічним ефектом є сповільнення проведення в АВ-вузлі. Саме це визначає і роль АТФ та аденозину в аритмології. Практично єдиною сферою їх застосування є припинення надшлуночкових тахікардій, спричинених механізмом ре-ентрі з залученням АВ-вузла (АВ-реципрокних тахікардій).
Особливістю АТФ є надзвичайно короткий період напіввиведення (до 10 с). Максимальний ефект досягається протягом 10–30 секунд після введення і триває не довше ніж 1 хвилину. Тому препарат потрібно вводити максимально швидко. Існують різні схеми введення. Наприклад, в окремих дозах 5, 10, 15 мг кожні 1–2 хвилини до припинення тахікардії. Ефективність такої тактики досить висока і за різними даними сягає 80–100 %.
Серед кардіальних побічних ефектів найчастіше реєструються синусова брадикардія, транзиторна зупинка синусового вузла та АВ-блокада. З некардіальних ефектів найчастіше реєструються відчуття жару, головний біль, біль у грудній клітці. Як і основна дія, побічні ефекти тривають недовго і минають протягом 1–2 хвилин. Абсолютним протипоказанням до введення АТФ чи аденозину є наявність бронхіальної астми в анамнезі.
Дозування основних антиаритмічних препаратів наведено в табл. 4.
Таким чином, фармакотерапія аритмій займає важливе місце у щоденній практиці лікаря. На сьогодні існує велика кількість антиаритмічних препаратів, ефективних при різних порушеннях ритму. Завдання практичного лікаря — розібратись у цьому розмаїтті та вибрати найефективнішу та найбезпечнішу тактику в кожному конкретному випадку з урахуванням не лише характеру аритмії, а і стану серцево-судинної системи взагалі, можливих переваг та ризиків лікування. Лише при такому підході можна досягти успіху в покращенні якості та тривалості життя пацієнта.