Газета «Новости медицины и фармации» Кардиология (338) 2010 (тематический номер)
Вернуться к номеру
Хронічна серцева недостатність — ревізія сучасних уявлень про діагностику і лікування
Авторы: В.К. Тащук, Т.О. Ілащук, Кафедра внутрішньої медицини, фізичної реабілітації, та спортивної медицини Буковинського державного медичного університету, м. Чернівці
Версия для печати
Сучасні аспекти діагностики і лікування серцевої недостатності (СН), причини, нейрогуморальні чинники, моделі розвитку та вплив на їх лікування пов’язані з використанням класичних терапевтичних підходів — діуретиків, дигіталісу, інгібіторів ангіотензинперетворюючого ферменту (ІАПФ), блокаторів рецепторів ангіотензину (БРА), β-адреноблокаторів (β-АБ), антагоністів альдостерону (АА). У сьогоденній кардіології активно впроваджуються інноваційні підходи з використанням селективних антагоністів альдостеронових рецепторів, сенсибілізаторів іонів кальцію, мозкового натрійуретичного пептиду, інгібіторів реніну, антагоністів рецепторів вазопресину, антагоністів рецепторів ендотеліну, інгібіторів вазопептидаз, селективних антагоністів аденозинових рецепторів, інгібіторів окиснення жирних кислот, інгібіторів фосфодіестерази ІІІ, стимуляторів еритропоезу.
Хронічна серцева недостатність (ХСН) є медико-соціальною проблемою, що визначена домінуючою у найближчі роки в усьому світі, оскільки середня тривалість життя хворих на ХСН від моменту встановлення діагнозу становить від 1,7 до 7 років і при тривалому спостереженні свідчить про підвищення ризику смерті, що на 5-й рік у 4 рази перевищує початкові значення [4]. ХСН є надзвичайно поширеним синдромом (2–3 % в популяції, у старшій віковій групі — 10 %), що ускладнює перебіг захворювань серцево-судинної системи, наслідком чого є зниження насосної функції серця, дисбалансу між гемодинамічною потребою організму і можливостями серця, хронічної гіперактивації нейрогормональних систем, задишкою, серцебиттям, підвищеною стомлюваністю, обмеженням фізичної активності і надмірною затримкою рідини в організмі [1]. Ключовими моментами ХСН визнані такі:
— висока захворюваність і поширеність;
— обмежена працездатність, висока смертність;
— дорогий кошторис — 2 % з бюджету системи охорони здоров’я;
— піддається лікуванню — розроблена досить ефективна фармакотерапія.
Клінічна дефініція СН, згідно з ESC’2007–2009 [14], проводиться за наявних типових скарг (задишка у спокої/при фізичному навантаженні, стомлюваність, набряки) та проявів (тахікардія, тахіпное, кардіомегалія, III серцевий тон, серцеві шуми, зміни на ехокардіограмі, гепатомегалія, застійні явища в легенях, плевральний випіт, підвищений тиск в яремних венах, периферичні набряки, підвищений уміст натрійуретичного пептиду — в тому числі мозкового натрійуретичного пептиду (BNP) та попередника BNP — NT-proBNP, що триваліше циркулює в крові та є незалежним предиктором дисфункції лівого шлуночка (ЛШ) та виживаності).
Показники поширеності СН (табл. 1) є високими та становлять: у світі — 22 млн випадків, у США — 5 млн. Рівень інцидентності є надзвичайно високим: у світі — 2 млн нових щорічних випадків, у США — 500 000 нових щорічних випадків. Аналогічний розподіл кількості госпіталізацій, що становить для США 978 000 випадків щорічно в похилому віці, 6 % усіх госпіталізацій. І врешті-решт, залишається надзвичайно високий рівень смертності в даної категорії пацієнтів — 285 000 випадків щорічно в США, причому раптова серцева смерть при СН у 6– 9 разів більша, ніж у загальній популяції США [14–16].
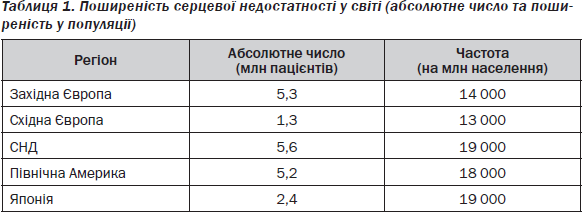
Згідно з висновком статистичного контролю США, кошторис і витрати на лікування СН, що наведені на рис. 1, є надзвичайно високими і становлять загалом щорічно 29,6 млрд доларів США з перевагою в розподілі витрат на госпіталізацію [15]. У той же час витрати на придбання медикаментів дорівнюють 3,1 млрд доларів (рис. 1).
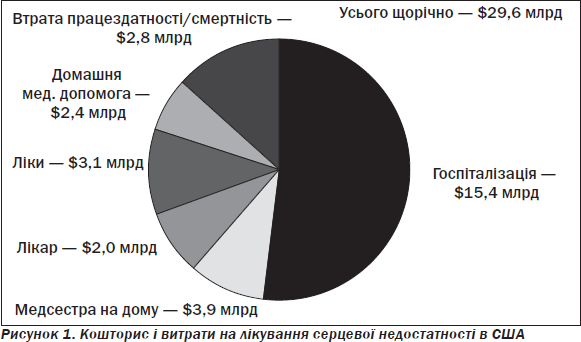
Причому сегмент трансплантацій серця (рис. 2) залишається надзвичайно низьким.
Патогенетичними причинами госпіталізації є етіологічні чинники, в тому числі міокардіальні аномалії (ішемічна хвороба серця), гемодинамічне перевантаження, аномалії наповнення шлуночків, шлуночкова диссинергія, аритмії, у той час як серед клінічних домінують набряковий синдром (55 % випадків), ішемізація міокарда (25 %), аритмії (15 %), артеріальна гіпертензія (6 %), що обумовлене проблемами дефініції СН. Як відзначив професор L. Tavazzi (2007) на Європейському конгресі з серцевої недостатності в доповіді «Тягар синдрому гострої СН», доцільним є визначення синдрому гострої СН як кластеру хворобливих станів з різними проявами (гемодинамічними, клінічними) та наслідками (недостатньо ідентифікованими), а G. Filippathos на цьому ж конгресі підкреслює високу ймовірність констеляції СН і гострого коронарного синдрому (20,4 %), що в 3–4 рази збільшує смертність.
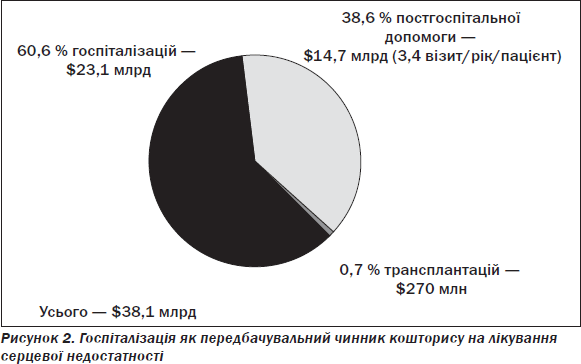
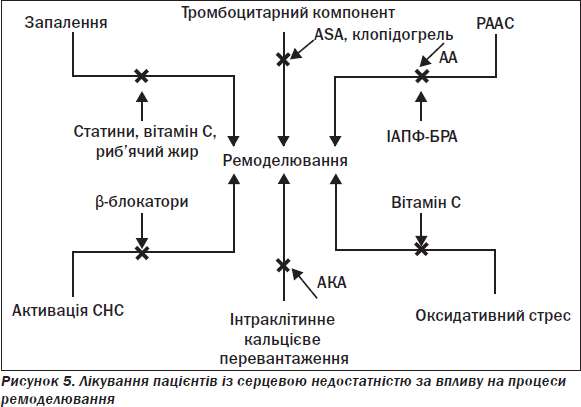
Основним патогенетичним шляхом формування СН є експресія мутантних генів, збільшення навантаження, нейрогормональна стимуляція, активація симпатоадреналової (САС), ренін-ангіотензин-альдостеронової (РААС) та цитокінової систем, зменшення загальної перфузії, затримка Na+ в нирках, ендотеліальна дисфункція, ремоделювання ЛШ зі збільшенням тиску легеневої артерії (ЛА), кінцевого діастолічного об’єму (КДО) та зменшенням скоротливості, що визначає загальна фракція викиду (ФВ), наступна вазоконстрикція, ішемія і дефіцит енергії та врешті-решт загибель клітин міокарда (апоптоз і некроз). При цьому ураження серця є причиною і наслідком СН, як наведено на рис. 3 у вигляді порочного кола.
У діагностиці та лікуванні цього порочного кола дуже важливим є розподіл міокардіальної дисфункції щодо систолічної/діастолічної дисфункції ЛШ при розвитку СН. Більшість пацієнтів із СН мають ознаки як систолічної, так і діастолічної дисфункції. Розвиток СН із систолічною дисфункцією ЛШ діагностують переважно при первинному ураженні серцевого м’яза (ураження міокарда при ішемічній хворобі серця (ІХС), дилатаційній кардіоміопатії, дифузному міокардиті, внаслідок перевантаження тиском чи об’ємом — кінцеві стадії гіпертензивного серця, аортальних вад, мітральної недостатності). Отже, систолічна дисфункція — це ФВ < 40 %, зменшення серцевого викиду, збільшення КДО, що виникає, як правило, внаслідок коронарного захворювання.
У той час як діастолічна СН — зниження ударного об’єму при недостатньому наповненні у діастолу одного/обох шлуночків за порушення їх активного розслаблення та/або пасивного розтягнення, зменшення діастоли або механічних перешкод. Скорочувальна здатність шлуночків істотно не порушується, є характерною для артеріальної гіпертензії, гіпертрофії ЛШ, тривалій тахікардії (хворі на СН із ФВ > 45 % при недилатованому ЛШ та доплер-ехокардіографічними порушеннями діастолічної функції) [2]. Отже, діастолічна дисфункція — це нормальна/збільшена ФВ, зменшення серцевого викиду, зменшення КДО, існує «проблема з релаксацією» ЛШ, що виникає, як правило, внаслідок коронарного захворювання. Рекомендований експертами ESC термін «СН зі збереженою фракцією викиду ЛШ». Звідси виникає розподіл ефективного лікування хворих з проявами СН залежно від систолічної/діастолічної дисфункції (табл. 2).
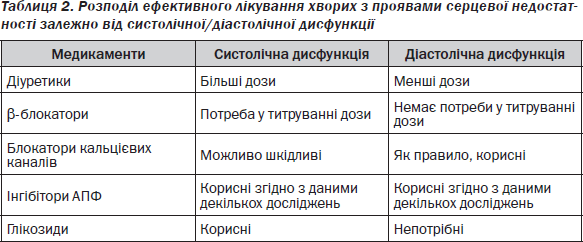
Медикаментозне лікування СН має тривалу історію, що активно нарощується останніми роками [5], подане в хронорозподілі на рис. 4.
Досягнення мети лікування СН базується на реалізації двох положень — зменшення симптоматики та проявів СН (діуретики, дигіталіс, інгібітори ангіотензинперетворюючого ферменту, β-адреноблокатори або зменшення проявів частоти ускладнень та смертності (ІАПФ, β-АБ, спіронолактон, аміодарон).
Взагалі патогенетичні моделі розвитку СН та можливості їх лікування пов’язані з такими 5 концепціями [1].
1. Кардіальна модель — механістичний зв’язок обмеження роботи серця та розвитку СН, що потребує використання серцевих глікозидів.
2. Кардіоренальна модель — з визначенням провідної ролі нирок, затримкою рідини, порушенням дегідратації з розвитком СН, що акцептує використання конкурентного антагоніста альдостерону як нейрогормональної модуляції.
3. Гемодинамічна модель — з активацією констрикції венул та збільшенням притоку крові до ЛШ у діастолу (переднавантаження), в той час як спазм артеріол ускладнює випорожнення ЛШ у систолу (постнавантаження), а отже, можливим є використання периферичних вазодилататорів з розширенням артеріол і вен та зменшенням перед- і постнавантаження.
4. Нейрогуморальна модель — нейрогормональні модулятори потребують використання ІАПФ.
5. Міокардіальна модель — з домінантним ремоделюванням ЛШ, розвитком кардіоміопатії наднавантаження, а отже, впровадження ІАПФ і β-АБ.
При цьому досягається реалізація таких моделей: об’ємне розвантаження серця (діуретики), гемодинамічне розвантаження серця (вазодилататори, нітрати, блокатори кальцієвих каналів), нейрогуморальне розвантаження серця (ІАПФ, блокатори рецепторів ангіотензину — сартанів, антагоністів альдостерону), міокардіальне розвантаження серця (β-АБ, аміодарон) та ізотропна стимуляція (серцеві глікозиди). Таким чином, за застійної моделі розвитку СН доцільно використовувати діуретики, дигоксин, за гемодинамічної — вазодилататори, за нейрогуморальної — ІАПФ, β-АБ, АА, за імунної — інгібітори цитокінів.
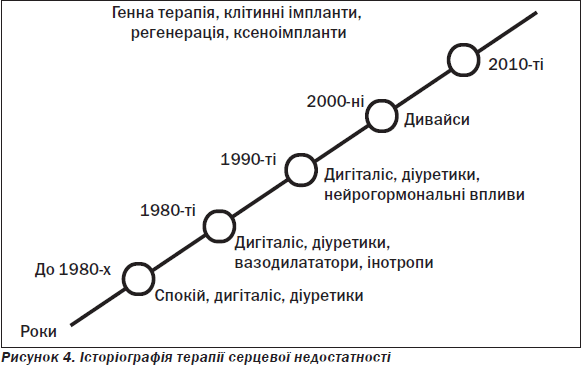
«Ремоделювання» — термін, уведений у літературу N. Sharp наприкінці 70-х років, розглядається як зміни в часі архітектоніки і функції шлуночків з експансією рубцевої тканини за умов активованого нейрогуморального фону з розвитком гострого інфаркту міокарда, постінфарктного кардіосклерозу, «приголомшеного» (stunned) міокарда, «сплячого» (hybernating) міокарда, ішемічної кардіоміопатії, транзиторної ішемії та потребує впровадження схеми лікування СН згідно з наведеним на рис. 5 блокуванням ланцюгів.
Незважаючи на успіхи, першою лінією лікування СН з явищами затримки рідини залишаються діуретики (рівень доказовості ІВ), оскільки зменшують переднавантаження, оптимізують легеневе і системне венозне повертання та циркуляцію, покращують симптоми. Результати субаналізу дослідження ALLHAT [13] свідчать про меншу частоту СН при використанні хлорталідону, ніж амлодипіну або лізиноприлу з відносним ризиком 1,35 і 1,11 відповідно (р < 0,001 і р = 0,09). Дослідження TORIC [12] доводить клінічну ефективність і безпеку торасеміду порівняно з фуросемідом у 1377 хворих на хронічною СН II–III функціонального класу (ФК), оскільки зниження ФК визначено у 45,8 і 37,2 % хворих двох груп (р = 0,00017), частота гіпокаліємії наприкінці дослідження становила відповідно 12,9 і 17,9 % (р = 0,013) з нижчою летальністю в групі торасеміду (2,2 проти 4,5 % у групі порівняння; р < 0,05).
Не доведений позитивний вплив дигоксину на виживаність хворих на СН зі збільшенням ризику аритмічної смерті при концентрації препарату в крові понад 1,0 нг/мл (приблизно відповідає добовій дозі 0,25 мг і більше) [7]. Згідно з аналізом результатів дослідження DIG, при збереженій систолічній функції і ФВ > 45 % і в жінок із СН, систолічною дисфункцією і ФВ ≤ 45 % дигоксин збільшує смертність і не впливає на частоту госпіталізацій, а у чоловіків з ХСН і ФВ ≤ 45 % дигоксин зменшує потребу в госпіталізаціях і не впливає на смертність [6]. Зменшення концентрації дигоксину в крові пов’язується з меншим співвідношенням ризику для кардіоваскулярної смерті і смерті від СН — 0,87 (95% довірчий інтервал (ДI) 0,76–1,01; p = 0,072) і 0,66 (95% ДI 0,52–0,85; p = 0,001), як і для госпіталізацій за наростання СН 0,82 (95% ДI 0,75–0,89; p < 0,0001) і 0,59 (95% ДI 0,52–0,66; p < 0,0001) [8]. Показаннями до його використання є відсутність адекватної відповіді на лікування (ІАПФ + діуретики + β-АБ), наявність фібриляції передсердь (частота серцевих скорочень (ЧСС) у спокої > 80 уд/хв, при навантаженні > 110–120 уд/хв), однак з метою контролю ЧСС оптимальним є використання β-АБ (ізольовано або в комбінації з дигоксином).
Збільшення загального периферичного судинного опору при ХСН в умовах рефлекторної активації РААС і САС у відповідь на зменшення серцевого викиду свідчить про доцільність використання селективних блокаторів β1-адренорецепторів, що блокують небажані при СН ефекти гіперактивації САС та мінімально впливають на β2- і β3-адренорецептори, які опосередковують позитивні ефекти катехоламінів [3]. Отже, β-АБ рекомендовані для лікування усіх пацієнтів зі стабільною легкою, помірною та тяжкою СН ішемічного та неішемічного генезу у складі стандартної терапії, включаючи ІАПФ та діуретики. Бісопролол, карведилол, метопролол сукцинат та небіволол можуть бути використані в лікуванні хворого на СН [14]. У дослідженні CIBIS III за використання конкору, що проаналізований у зіставленні з ІАПФ при СН, доведене зменшення ймовірності раптової серцевої смерті на 46 % [24]. Згідно з результатами дослідження COMET, зменшення смертності хворих, яким призначали карведилол, було більшим на 17 %, ніж тих, які приймали метопролол [21].
У лікуванні пацієнта з СН домінує використання ІАПФ [14], оскільки препарати зменшують деградацію брадикініну, збільшують синтез простагландинів, зменшують загальнопериферичний судинний опір, артеріальний тиск, переднавантаження, тиск у легеневих капілярах, збільшують хвилинний об’єм кровообігу, підвищують толерантність міокарда до навантаження, більше розширюють артерії, ніж вени, зменшують ознаки гіпертрофії ЛШ і стінок артерій резистивного типу, покращують кровопостачання за ішемії (дослідження CONSENSUS, SOLVD, VHeFT, ATLAS, GISSI–3, ALLHAT). Інгібітори АПФ рекомендовані як терапія першої ланки при зниженій систолічній функції ЛШ (ФВЛШ < 40–45 %) з рівнем доказовості IА. При відсутності набряків першими призначаються інгібітори АПФ, а при їх наявності — разом з діуретиками (ІА). Отже, безумовна доказовість ефективності ІАПФ (SOLVD) є доведеною, і результати досліджень Val-HEFT, CHARM-Added, CHARM-Alternative, VALIANT свідчать про обгрунтованість використання БРА та можливість їх комбінації з ІАПФ. Однак, хоча ІАПФ покращують виживання пацієнтів з СН, препарати цієї групи, як і БРА, не впливають на частоту серцевих скорочень та ризик раптової серцевої смерті, що спостерігається при використанні β-АБ.
Вплив АА (еплеренон), селективного антагоніста альдостеронових рецепторів, подібний до спіронолактону, але при цьому через більшу вибірковість дії менше впливає на рецептори статевих гормонів і рідше викликає пов’язану з цією дією гінекомастію, на частоту критичних подій при гострому коронарному синдромі та їх ранньому застосуванні, свідчить про суттєве зменшення смертності від усіх причин, раптової серцевої смерті (РСС) та реадмісії за СН, як свідчить дослідження EPHESUS [20].
Поєднане призначення гідралазину та ізосорбіду динітрату (V-HeFT-I, A-HeFT, V-HeFT-II) може використовуватися як альтернатива ІАПФ і БРА, особливо при наявних симптомах СН за звичного передуючого використання ІАПФ/БРА, β-АБ, АА, діуретиків з огляду на зниження ризику смерті та госпіталізації з приводу прогресування СН, оптимізацію функції шлуночків і толерантності до навантаження.
Схема використання медикаментозних і немедикаментозних підходів у лікуванні СН формує такий алгоритм:
A — ІАПФ, антикоагулянти, аміодарон;
B — β-АБ;
C — блокатори кальцієвих каналів, коронарна реваскуляризація, трансплантація серця, серцева хірургічна редукція, кардіоміопластика;
D — дієта, діуретики, серцеві глікозиди, добутамін;
E — фізичні вправи.
Загалом концепцію лікування СН згідно з механізмом порочного кола подано на рис. 6.
Слід розподілити препарати, які використовують для лікування СН, на ті, що зменшують смертність (β-AБ, ІАПФ, БРА, АА, ізосорбід та гідралазин у темношкірих), ті, що, можливо, покращують симптоми без негативного прогнозу (серцеві глікозиди та петльові діуретики), і ті, що збільшують смертність (Dobutamine, Xamoterol, Pimobendam, Flosequinan, Vesnarinone, Ibopamine, Inamrinone, Milrinone, Enoximone).
Сучасні підходи до лікування пацієнтів із СН базуються на використанні:
1) новітніх нейрогормональних модуляторів;
2) новітніх інотропів;
3) генної терапії;
4) трансплантації міозитів;
5) неоангіогенезу/факторів росту.
Вивчається дія при СН новітніх нейрогормональних модуляторів, таких як БРА, АА, антагоністи рецепторів ендотеліну, антагоністи рецепторів вaзопресину, натрійуретичні пептиди, інгібітори ендопептидази, інгібітори вазопептидази, кальцієві сенсибілізатори.
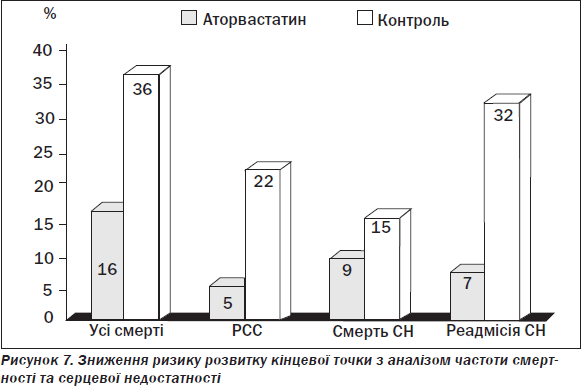
Активно обговорюються плейотропні ефекти статинів при лікуванні хворих на СН, у тому числі доведений позитивний вплив аторвастатину на зменшення загальної смертності, раптової серцевої смерті, проявів СН, як наведено на рис. 7 [23].
Узагалі майбутнє в лікуванні СН, як зазначалось на Європейському конгресі кардіологів’2007–2009, пов’язується з вивченням ефективності застосування таких препаратів.
1. Селективні антагоністи альдостеронових рецепторів (еплеренон).
2. Сенсибілізатори іонів кальцію (левосимендан).
3. Мозковий натрійуретичний пептид (несиритид).
4. Інгібітори реніну (аліскірен).
5. Антагоністи рецепторів вазопресину (толваптан).
6. Антагоністи рецепторів ендотеліну (босентан).
7. Інгібітори вазопептидаз (омапатрилат).
8. Селективні антагоністи аденозинових рецепторів (адентри).
9. Інгібітори окиснення жирних кислот (ранолазин).
10. Інгібітори фосфодіестерази ІІІ (еноксимон).
11. Стимулятори еритропоезу (еритропоетин) тощо.
Надзвичайно актуальною є роль натрійуретичних пептидів при СН, які виробляються в міокарді передсердь (ANP), міокарді шлуночків (BNP), ендокарді (CNP) та сприяють натрійурезу і вазодилатації, пригнічують РААС та функцію ендотелію. Доведено, що діагноз СН є малоймовірним за вмісту BNP < 100 пг/мл та NT-proBNP < 400 пг/мл, невизначеним при вмісті BNP 100–400 пг/мл та NT-proBNP 400–2000 пг/мл, високоймовірним — якщо BNP > 400 пг/мл та NT-proBNP > 2000 пг/мл.
Підвищені рівні ангіотензину II, ендотеліну, вазопресину, альдостерону частково врівноважуються збільшенням утворення натрійуретичного пептиду, що має вазодилатуючий, діуретичний і натрійуретичний вплив, гальмує процеси клітинного росту і перешкоджає розвитку фіброзу. При СН ці позитивні ефекти пригнічуються частково через коротку тривалість життя натрійуретичного пептиду, тому рекомендовані шляхи стабілізації проявів СН, або застосування натрійуретичного пептиду, або уповільнення його деградації (блокада нейтральної ендопептидази). Відомо, що несиритид [11] є ідентичним до людського натрійуретичного пептиду, спричинює вазодилатацію та знижує тиск наповнення ЛШ, знижує тиск у легеневих капілярах, полегшує симптоми СН — зменшує задишку, внаслідок покращення гемодинамічних та деяких самоопосередкованих симптомів більш ефективний і з кількома побічними ефектами, ніж внутрішньовенний нітрогліцерин (дослідження VMAC).
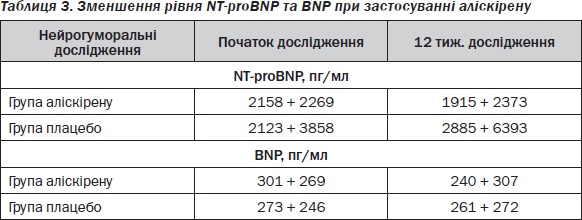
Одним із шляхів пригнічення підвищеної активності РААС при СН є пряме інгібування реніну. Аліскірен — перший представник нового класу прямих інгібіторів реніну в дозах 150 і 300 мг один раз на добу. Як зазначає J. McMurray et al. (2008) [18], використання аліскірену проти плацебо упродовж 12 тижнів у 302 хворих з ознаками СН при наявній гіпертензії та рівні BNP > 100 пг/мл у комплексі зі стандартною терапією ІАПФ/БРА свідчить про позитивні розбіжності показників натрійуретичного пептиду на фоні лікування аліскіреном (табл. 3).
Підвищення концентрації аргінін-вазопресину в крові, що відзначається при СН, може сприяти розвитку вазоконстрикції, фіброзу і гіпертрофії міокарда (за рахунок активації V1a-рецепторів), затримці води в організмі і гіпонатріємії (за рахунок активації V2-рецепторів). Застосування антагоністів вазопресину на відміну від ІАПФ і β-АБ може не тільки запобігати прогресуванню дисфункції ЛШ, але також істотно зменшувати вираженість застійних явищ і гіпонатріємії. Толваптан — непептидний антагоніст V2-рецепторов, що не має властивостей агоніста. При хронічній СН синтез вазопресину значно підвищений, а отже, збільшується периферичний судинний опір, що сприяє затримці рідини в організмі, обумовлює негативний вплив на гемодинаміку і ремоделювання серця, тобто селективні (толваптан 30 мг один раз на день, ліксиваптан — блокують V2-рецептори) і неселективні (коніваптан — блокує V1- і V2-рецептори) антагоністи рецепторів вазопресину значно збільшують екскрецію рідини з організму і осмолярність плазми у пацієнтів з СН, зменшують масу тіла і симптоми застою у таких хворих. Коніваптан значно знижує тиск заклинювання в легеневих капілярах, не змінюючи при цьому системний судинний опір і серцевий викид. Результати дослідження EVEREST свідчать, що клінічно толваптан є кращим, ніж плацебо, — менша задишка (оптимізація 74 % проти 68 % пацієнтів; р < 0,001), втрата маси тіла за 1-шу добу (на 1,76 кг проти 0,97 кг; р < 0,001), зменшення набряків за 7 діб (р = 0,003) і збільшення натрію при початковій гіпонатріємії (р < 0,001). Однак не досягнуто в групах втручання і контролю переваги толваптану щодо плацебо, згідно з тривалим спостереженням за смертністю, що становила 25,9 і 26,3 % (співвідношення ризику 0,98; 95% ДІ 0,87–1,11; р = 0,68), поєднання кінцевої точки (смерті від серцево-судинних причин і госпіталізацій з приводу СН) між групами не визначено (871 (42,0 %) пролікований хворих проти 829 (40,2 %) плацебо — співвідношення ризику 1,04; 95% ДІ 0,95–1,14; р = 0,55) [10].
Ендотелінова система відіграє важливу роль у патогенезі СН, а отже, антагоністи ендотелінових рецепторів (ЕТА і ЕТB) слід розглядати як перспективний підхід до лікування [22]. Існують неселективні антагоністи ЕТ-рецепторів (1-ше покоління: босентан, тезосентан) і селективні антагоністи ЕТА-рецепторів (2-ге покоління: амбрисентан, атрасентан, дарусентан, ситаксентан). У дослідженні REACH терапія хворих на СН босентаном у добовій дозі 1000 мг протягом 6 місяців знижувала частоту госпіталізацій у зв’язку з ХСН і смертністю, проте наголошувалося на високій частоті гепатотоксичності. У зв’язку з цим у дослідженні III фази REACH II вивчаються ефективність і безпека при СН босентану у добовій дозі 250 мг.
Омапатрилат — перший представник нового класу лікарських засобів з групи інгібіторів вазопептидази. Блокада нейтральної ендопептидази сприяє збільшенню тривалості життя натрійуретичного пептиду за рахунок зменшення його деградації. Препарат цієї групи має селективну інгібуючу активність до нейтральної ендопептидази й АПФ, активує велику кількість ендогенних судинорозширювальних пептидів (серед яких передсердний натрійуретичний пептид, брадикінін і адреномедулін), пригнічує утворення ангіотензину II. Наведено результати клінічних випробувань, що продемонстрували високу ефективність препарату у пацієнтів із СН і артеріальною гіпертензією (дослідження OCTAVE, OPERA, OVERTURE) зі зниженням летальності, зростанням толерантності до навантаження, покращенням функціонального класу СН [25].
Селективні антагоністи аденозинових рецепторів типу I (А1-рецепторів) нормалізують ренальну функцію шляхом вазодилатації аферентної артеріоли і руйнування зворотного тубулогломерулярного зв’язку (адентри — препарат, що має властивості калійзберігаючого діуретика). Оцінка ефективності адентри свідчить про його вплив на збільшення гломерулярної фільтрації і об’єму діурезу, а отже, збільшується діурез без ураження гломерулярної функції при СН (дослідження TRIDENT-1).
Інгібітори окиснення жирних кислот — препарати метаболічної дії, що сприяють трансформації більш ефективної утилізації кисню від окиснення жирних кислот до окиснення глюкози, за рахунок чого зменшується потреба міокарда в кисні, при цьому робота серця не змінюється. Ранолазин — препарат, що рекомендований до лікування стабільної стенокардії, є селективним інгібітором пізнього натрієвого потоку, знижує індуковане ішемією перенавантаження клітини натрієм і кальцієм, за рахунок чого покращує перфузію і функціональні можливості міокарда (а відтак його застосування логічне у випадку СН), регулює аномалії шлуночкової реполяризації та скорочуваності [19].
Корекція систолічної дисфункції міокарда можлива за використання серцевих глікозидів, катехоламінів та інгібіторів фосфодіестерази ІІІ. Затримка впровадження інгібіторів фосфодіестерази ІІІ при СН пов’язана з проаритмогенними впливами препаратів цієї групи (мілринон), досліджується можливість використання еноксимону в комбінації з β-АБ, що зменшують ризик проаритмогенного ефекту без впливів на інотропізм препарату. Також активно використовують сенсибілізатори Ca++ (левосимендан), що не потребують енергозатрат, не викликають перевантаження кальцію, мають кардіотропну дію [9].
Продовжується дослідження при СН засобів з антиадренергічним (Moxonidine (дослідження MOXCON) та Prazosin (V-HeFT1)) та антицитокіновим (Anti-TNF (ATTACH) та Etanercept (RENEWAL)) ефектом, а також таких, що інгібують фактор некрозу пухлини α. Також подовжено дослідження ролі еритропоетину, мaтриксної металопротеїнази, гормону росту, L-тироксину, інгібіторів карнітин-пальмітил-трансферази-I, інгібіторів допамін-β-гідроксилази, антитромботичних засобів, статинів.
Щодо останніх двох груп препаратів слід зазначити цікаву концепцію дослідження WATCH (Warfarin and Antiplatelet Therapy in Chronic Heart Failure) [17] з дизайном, що підпорядкований вирішенню положення «антикоагуляція варфарином ефективніше запобігає основним серцево-судинним подіям, ніж антитромбоцитарна терапія аспірином; терапія клопідогрелем — антиагрегантом, не пов’язаним з інгібуванням простагландинів, ефективніша за застосування аспірину». Співвідношення ризику загальної смертності, нефатальних інфарктів і інсультів для терапії варфарином проти аспірину становило 0,98 (95% ДІ 0,86–1,12; р = 0,77), для терапії клопідогрелем проти аспіри- ну — 1,08 (95% ДІ 0,83–1,40; р = 0,57) і для терапії варфарином проти клопідогрелю — 0,89 (95% ДІ 0,68–1,16; р = 0,39). У групі аспірину відзначено більше пацієнтів, госпіталізованих у зв’язку з декомпенсацією СН, ніж у групі варфарину (116 проти 89 випадків, або 22,2 % проти 16,5 %; р = 0,019), як і загальне число госпіталізацій (218 проти 155 випадків; р < 0,001). Число госпіталізованих хворих і госпіталізацій у групі клопідогреля займає проміжну позицію (97 і 18,5 %). Співвідношення ризику для комбінації смерті та госпіталізації з приводу СН є таким: для варфарину проти аспірину — 0,94 (95% ДІ 0,84–1,04; р = 0,22); для клопідогрелю проти аспірину — 0,97 (95% ДІ 0,78–1,21; р = 0,79); для варфарину проти клопідогрелю — 0,90 (95% ДІ 0,72–1,12; р = 0,37). Отже, зіставлення трьох антитромботичних режимів при систолічній СН не визначило істотних відмінностей між терапією варфарином, аспірином і клопідогрелем щодо первинної кінцевої точки і загальної смертності.
Таким чином, дослідження можливості лікування хворих з ознаками СН та розробка нових медикаментозних підходів продовжуються, в тому числі імплантація кардіовертера-дефібрилятора є раціональною у пацієнтів із ФВ ЛШ < 30–35 %, на фоні оптимальної терапії, що включає застосування ІАПФ, БРА, β-АБ, АА з метою зменшення ризику раптової смерті (рівень доказової медицини IА).
1. Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. Раздел 2. Определение понятия ХСН, причины развития, патогенез, классификация и цели терапии // Consilium medicum. (http://old.consilium-medicum.com/media/book/01_01/16.shtml).
2. Воронков Л.Г., Амосова К.М., Багрій А.Е. та співавт. Рекомендації Української асоціації кардіологів з діагностики, лікування та профілактики хронічної серцевої недостатності у дорослих // Український кардіологічний журнал. — 2006. — № 4. — С. 114-121.
3. Дзяк Г.В., Ханюков А.А. Аспекты рационального применения блокаторов β-адренорецепторов в лечении хронической сердечной недостаточности. Результаты сравнительного исследования эффективности и безопасности селективных блокаторов β-адренорецепторов // Укр. мед. часопис. — 2009. — № 6(74). — С. 37-42.
4. Коваленко В.Н., Онищенко Е.В., Рябенко Д.В. Изучение выживаемости и функции риска смерти у пациентов с хронической сердечной недостаточностью различного генеза: результаты 5-летнего проспективного исследования // Укр. мед. часопис. — 2008. — № 4(66). — С. 32-36.
5. Рябенко Д.В. Некоторые проблемы фармакотерапии хронической сердечной недостаточности // Укр. кардіол. журн. — 2009. — № 3. — (http://www.nbuv.gov.ua/portal/Chem_Biol/Ukzh/2009_3/Ryabenko_3_09.pdf)
6. Сидоренко Б.А., Преображенский Д.В., Шарошина И.А. и др. Место сердечних гликозидов в лечении хронической сердечной недостаточности. Часть III: Исследование DIG // Кардиология. — 2005. — № 6. — (http://www.mediasphera.ru/journals/detail/3675/)
7. Ahmed A., Rich M.W., Love T.E. et al. Digoxin and reduction in mortality and hospitalization on heart failure: a comprehensive post hoc analysis of the DIG trial // Eur. Heart. J. — 2006. — Vol. 27, № 2. — P. 178-186.
8. Ahmed A., Waagstein F., Pitt B. et al. Effectiveness of digoxin in reducing one-year mortality in chronic heart failure in the Digitalis Investigation Group trial // Am. J. Cardiol. — 2009. — Vol. 103, № 1. — P. 82-87.
9. Altenberger J., Parissis J.T., Ulmer H. Rationale and design of the multicentre randomized trial investigating the efficacy and safety of pulsed infusions of levosimendan in outpatients with advanced heart failure (LevoRep study) // Eur. J. Heart Fail. — 2010. — Vol. 12, № 2. — P. 186-192.
10. Blair J.E., Zannad F., Konstam M.A. et al. Continental differences in clinical characteristics, management, and outcomes in patients hospitalized with worsening heart failure results from the EVEREST (Efficacy of Vasopressin Antagonism in Heart Failure: Outcome Study with Tolvaptan) program // J. Am. Coll. Cardiol. — 2008. — Vol. 52, № 20. — P. 1640-1648.
11. Burnett J.C. Nesiritide: new hope for acute heart failure syndromes? // Eur. Heart J. — 2005. — Vol. 7, Supplement B. — B25–B30.
12. Cosin J., Diez J. and TORIC investigators Torasemide in chronic heart failure results of the TORIC study // Eur. J. Heart Fail. — 2002. — Vol. 4, № 4. — P. 507-513.
13. Davis B.R., Piller L.B., Cutler J.A. et al. Role of Diuretics in the Prevention of Heart Failure // Circulation. — 2006. — Vol. 113, № 18. — P. 2201-2210.
14. Dickstein K., Cohen-Solal A., Filippatos G. et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2008. The Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM) // Eur. J. Heart. Fail. — 2008. — Vol. 10, № 10. — P. 933-989.
15. Hunt S.A., Abraham W.T., Chin M.H. et al. 2009 Focused Update Incorporated Into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults // J. Am. Coll. Cardiol. — 2009. — Vol. 53, № 15. — P. e1-e90.
16. Hunt S.A., Abraham W.T., Chin M.H. et al. ACC/AHA 2005 Guideline Update for the Diagnosis and Management of Chronic Heart Failure in the Adult. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines // Circulation. — 2005. — Vol. 112, № 12. — P. e154-e235.
17. Massie B.M., Collins J.F., Ammon S.E. et al. for the WATCH Trial Investigators. Randomized Trial of Warfarin, Aspirin, and Clopidogrel in Patients With Chronic Heart Failure The Warfarin and Antiplatelet Therapy in Chronic Heart Failure (WATCH) Trial // Circulati- on. — 2009. — Vol. 119, № 12. — P. 1616-1624.
18. McMurray J.J.V., Pitt B., Latini R. et al. Effects of the Oral Direct Renin Inhibitor Aliskiren in Patients With Symptomatic Heart Failure // Circulation: Heart Failure. — 2008. — Vol. 1, № 1. — P. 17-24.
19. Opie L.H., Knuuti J. The adrenergic-fatty acid load in heart failure // J. Am. Coll. Cardiol. — 2009. — Vol. 54, № 18. — P. 1637-1646.
20. Pitt B. Aldosterone blockade in patients with heart failure and a reduced left ventricular ejection fraction // Europ. Heart J. — 2009. — Vol. 30, № 4. — P. 387-388.
21. Poole-Wilson P.A., Swedberg K., Cleland J.G. et al. Comparison of carvedilol and metoprolol on clinical outcomes in patients with chronic heart failure in the Carvedilol Or Metoprolol European Trial (COMET): randomised controlled trial // Lancet. — 2003. — Vol. 362, № 9377. — P. 7–13.
22. Rehsia N.S., Dhalla N.S. Potential of endothelin-1 and vasopressin antagonists for the treatment of congestive heart failure // Heart Fail. Rev. — 2010. — Vol. 15, № 1. — P. 85-101.
23. Vrtovec B., Okrajsek R., Golicnik A. et al. Atorvastatin therapy decreases sudden cardiac death in patients with advanced chronic heart failure: a prospective study. European Society of Cardiology Congress 2007. — Austria, Vienna: September 4, 2007. — Abstract 3195.
24. Willenheimer R. How to begin treatment in chronic heart failure? Results of CIBIS III // Eur. Heart J. — 2006. — Vol. 8, Supplement C. — C43-C50.
25. Zanchi A., Maillard M., Burnier M. Recent clinical trials with omapatrilat: new developments // Curr. Hypertens. Rep. — 2003. — Vol. 5, № 4. — P. 346-352.
