Газета «Новости медицины и фармации» Гастроэнтерология (348) 2010 (тематический номер)
Вернуться к номеру
Токсические гепатиты: как повысить эффективность лечения?
Авторы: В.П. Шипулин, д.м.н., В.В. Чернявский, к.м.н., Национальная медицинская академия последипломного образования им. П.Л. Шупика, Национальный медицинский университет им. А.А. Богомольца, г. Киев
Версия для печати
Печень, как основная «лаборатория» организма, постоянно сталкивается с множеством потенциально токсических веществ, которые поступают в организм самыми разными путями, преимущественно через желудочно-кишечный тракт (ЖКТ), а детоксикационная функция является одним из важнейших назначений этого органа. Алкоголь, лекарства, промышленные и бытовые токсины — все это факторы, которые могут повреждать печень, несмотря на ее высокую регенераторную способность и значительные адаптивные возможности.
В настоящее время известно более 600 лекарственных средств и около 6 млн химических веществ с доказанной гепатотоксичностью. Облигатные токсины (мускарин, хлороформ) в средних дозах вызывают гепатит, и повреждение усугубляется с повышением дозы (эти вещества обладают так называемой внутренней гепатотоксичностью). Действие факультативных токсинов не зависит от дозы и обусловлено идиосинкразией (аминазин, изониазид, контрацептивы, метилдопа, хлортиазид, противоопухолевые). Медикаментозно-индуцированные гепатиты являются причиной 2–5 % госпитализаций по поводу синдрома желтухи. Кроме того, 50 % случаев острой печеночной недостаточности ассоциированы с острым лекарственным поражением печени. Следует заметить, что повреждение печени тем или иным лекарственным средством является наиболее частой причиной отзыва препаратов с фармацевтического рынка [1, 5–7, 10]. Но, так или иначе, некоторые клинические ситуации требуют применения потенциально гепатотоксических лекарств, которые могут вызывать самые разнообразные виды повреждения печени (табл. 1), к тому же распространено бесконтрольное применение лекарств в виде самолечения, что делает проблему медикаментозно-индуцированных токсических гепатитов чрезвычайно актуальной на сегодняшний день [7].

Факторами риска лекарственного поражения печени являются:
1) возраст и пол:
— у детей часто бывают передозировки;
— у пожилых снижается выделение лекарств;
— чаще страдают женщины;
2) наличие хронических заболеваний печени;
3) заболевания полых органов ЖКТ (лекарственные гепатиты развиваются в результате приема лекарственных средств при заболеваниях ЖКТ в 37 % случаев);
4) генетическая предрасположенность [5].
С диагностической точки зрения интерес представляет тот факт, что этиологическую роль лекарства в возникновении гепатита можно заподозрить в случае, когда активность трансаминаз через неделю после отмены препарата снижается на 50 % и более. Однако помимо цитолитического повреждения, когда наблюдается двукратное и более повышение активности АЛТ при нормальном уровне активности щелочной фосфатазы (ЩФ), лекарства могут индуцировать холестатическое повреждение (двукратное и более увеличение активности ЩФ при нормальной АЛТ) и смешанное повреждение (повышение активности и АЛТ, и ЩФ в 2 раза и более) [7, 10].
При остром и хроническом заболеваниях печени возникают той или иной степени нарушения протекающих в ней метаболических процессов. Кроме того, при токсическом гепатите всегда наблюдается гепатоцеллюлярная недостаточность разных степеней выраженности. Нарушение синтеза белка приводит к изменению аминокислотного состава крови, нарушениям процессов обезвреживания аммиака и гемокоагуляции. Воспалительно-некротические процессы в печени сопровождаются нарушением перекисного окисления липидов, истощением антиоксидантных ресурсов, в результате чего повреждаются мембраны гепатоцитов. Все это обосновывает применение такой группы препаратов, как гепатопротекторы, в комплексном лечении больных с острыми и хроническими гепатитами и циррозом печени. Гепатопротекторные средства улучшают обменные процессы в печени, повышают устойчивость печеночных клеток к воздействию внешних повреждающих факторов, способствуют восстановлению паренхимы печени и ее физиологических функций [6, 9–12].
Широкий ассортимент гепатопротекторных лекарственных препаратов, представленных на рынке Украины, традиционно используют для неспецифической терапии заболеваний печени. Они оказывают выборочное защитное действие на гепатоциты и опосредованный детоксикационный эффект. Производные силимарина и эссенциальные фосфолипиды, как было показано ранее, защищают клетки от повреждения, в некоторой степени восстанавливая частично поврежденные мембраны гепатоцитов, однако не восстанавливают функцию печени, если она нарушена [11, 12].
В то же время метаболические гепатопротекторы — производные аминокислот, помимо стимуляции клеточной регенерации, восстанавливают функции митохондрий и цитохромов печени, оказывая таким образом антитоксический эффект [6, 9, 11, 12].
Поэтому очень перспективным является применение препаратов на основе природных аминокислот, которые, включаясь в процессы метаболизма, оказывают целый ряд позитивных биологических эффектов. Тем более, что практическая медицина давно нуждается в гепатопротекторе, который бы, с одной стороны, связывал аммиак, а с другой — способствовал нормализации метаболизма ткани печени. Использование прямых корректоров аммиака в Украине недостаточно распространено в клинической практике, возможно, и по причине высокой стоимости этих препаратов.
Недавно на украинском фармацевтическом рынке появился новый, доступный с экономической точки зрения препарат этой группы — Орнитокс (L-орнитина-L-аспартат). Орнитокс обладает детоксикационным, метаболическим, анаболическим и антиоксидантным действиями, поэтому его применение у пациентов с токсическими поражениями печени представляется очень перспективным [7, 9], в связи с чем и было запланировано данное исследование.
Цель работы: определить эффективность L-орнитина-L-аспартата (Орнитокс) в лечении пациентов с алкогольной болезнью печени, токсическими гепатитами различной этиологии путем оценки его влияния на клинические, биохимические показатели и детоксикационную функцию печени.
Материалы и методы
Для достижения поставленной цели на кафедрах терапии НМАПО им. П.Л. Шупика и внутренней медицины № 1 НМУ им. А.А. Богомольца было обследовано 124 пациента (64 мужчины, 60 женщин) с клиническими и лабораторными (цитолитический и холестатический синдромы) признаками токсического гепатита. По этиологии пациенты распределились следующим образом: алкоголь — 40 чел., лекарства (антибиотики, цитостатики, противотуберкулезные средства, кетоконазол) — 52 чел., сочетанная этиология — 32 чел.
Вирусные поражения печени исключались методом ПЦР (real-time, качественный анализ). Всем пациентам до начала лечения и через 2 месяца было проведено УЗИ органов брюшной полости, лабораторное обследование — биохимическое исследование крови (АЛТ, АСТ, ЩФ, ГГТ, холинэстераза, общий белок и фракции, билирубин и фракции, тимоловая проба, креатинин, мочевина, мочевая кислота) выполнялось еженедельно.
Детоксикационная функция печени определялась с помощью 13С-метацетинового дыхательного теста (13С-МДТ) (табл. 2) до начала терапии, через 1 и 2 месяца [2–4].

Перед началом лечения методом простой слепой рандомизации пациенты были разделены на две группы: основную, в которую вошли 62 пациента (32 мужчины, 30 женщин), и контрольную — 62 пациента (32 мужчины, 30 женщин). Все пациенты дали информированное согласие на участие в исследовании. Прием лекарств, вызвавших повреждение печени, и алкоголя как этиологических агентов был исключен у всех пациентов.
Все пациенты основной исследуемой группы получали лечение L-орнитина-L-аспартатом 10 г (Орнитокс 2 ампулы по 10 мл) в 400 мл изотонического раствора натрия хлорида внутривенно капельно 8–12 капель в минуту 1 р/день — 14 дней. С 15-го дня пациенты принимали гранулят L-орнитина-L-аспартата по 1 пакетику на 200 мл воды 3 р/день еще в течение 45 дней (в общей сложности до 2 месяцев).
Контрольная группа была разделена на 2 подгруппы: пациенты первой из них получали эссенциальные фосфолипиды (внутривенно 15 суток с последующим приемом по 2 капсулы 3 р/день в течение 1,5 месяца), пациенты второй подгруппы получали внутрь силимарин 70 мг 3 р/день в течение 2 месяцев. Биохимическое исследование крови выполнялось еженедельно в группах сравнения, УЗИ и 13С-МДТ были выполнены до лечения и через 2 месяца терапии всем пациентам.
Результаты и их обсуждение
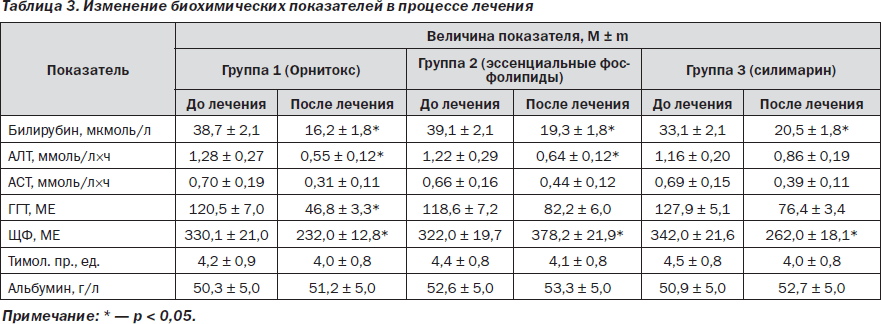
Динамика биохимических показателей в исследуемых группах представлена в табл. 3.
Полученные результаты свидетельствуют, что в результате лечения достоверно улучшились показатели общего билирубина во всех клинических группах. Динамика АЛТ была положительной в группах пациентов, получавших Орнитокс и эссенциальные фосфолипиды, достоверно положительной динамики показателей АЛТ и АСТ не было в группе пациентов, получавших в качестве гепатопротектора силимарин. Следует отметить, что нормализация биохимических показателей быстрее происходила в первой группе. Что касается показателей холестаза, то во второй группе динамика щелочной фосфатазы была достоверно отрицательной. Усугубление холестаза при лечении эссенциальными фосфолипидами в течение первых 3 месяцев лечения было отмечено и в других исследованиях [9].
По данным 13С-МДТ, проведенного до начала терапии, среднее значение суммарной концентрации С13 на 120-й минуте в первой группе составило 10,78 ± 2,31 ‰, во второй — 11,26 ± 1,82 ‰, в третьей — 10,89 ± 1,91 ‰. Достоверных отличий по этому показателю между группами не было (p > 0,05). Через 2 месяца лечения этот показатель составил в первой группе 22,6 ± 1,33 ‰, во второй группе — 17,11 ± 1,87 ‰, в третьей группе — 16,09 ± 1,96 ‰. Достоверное увеличение (p < 0,05) показателя суммарной концентрации С13 на 120-й минуте после лечения произошло только в группе, получавшей Орнитокс.
Таким образом, из всех использованных препаратов, назначенных с целью восстановления функции гепатоцитов, только Орнитокс оказал достоверно положительное влияние на детоксикационную функцию печени.
В целом можно говорить, что в случае токсического гепатита с 2-кратным и более повышением активности АЛТ пероральная терапия силимариновыми производными, наряду с простой отменой повреждающего фактора, недостаточно эффективна. Данный факт, возможно, связан с отсутствием внутривенной терапии на начальном этапе, поскольку в группах, получавших L-орнитина-L-аспартат и эссенциальные фосфолипиды, результаты лечения в целом выше. Кроме того, восстановление детоксикационной функции печени к окончанию курса лечения, которое наблюдалось в исследуемой группе, получавшей Орнитокс, можно трактовать как наиболее важный показатель эффективности терапии, говорящий в пользу метаболического гепатопротектора. Следует отметить интересный факт — усугубление лабораторных показателей холестаза на фоне лечения эссенциальными фосфолипидами, что говорит против применения данного гепатопротектора в случае холестатической формы токсического гепатита. L-орнитина-L-аспартат, опять же, этого существенного недостатка лишен. Интерес представляет динамика показателей в течение 1-го месяца лечения L-орнитина-L-аспартатом (табл. 4), которая была однозначно положительной по всем значениям — снижение показателей цитолиза и холестаза и повышение детоксикационной функции печени (рис. 1).
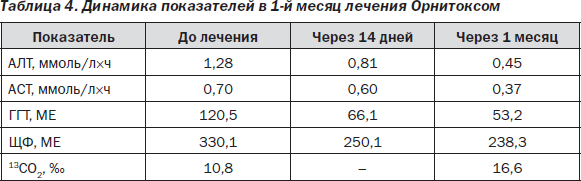
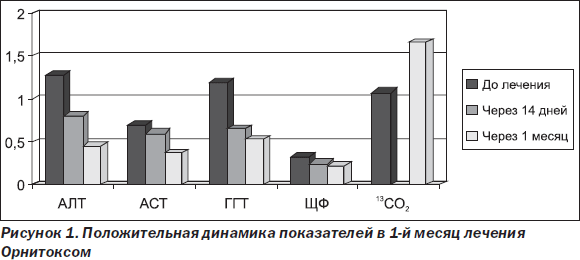
Как видно, особенно интенсивная положительная динамика наблюдалась в первые две недели, то есть когда проводилось внутривенное капельное введение препарата. Это, с одной стороны, можно объяснить терапевтическими свойствами самого препарата, а с другой — детоксикационным эффектом самих инфузий.
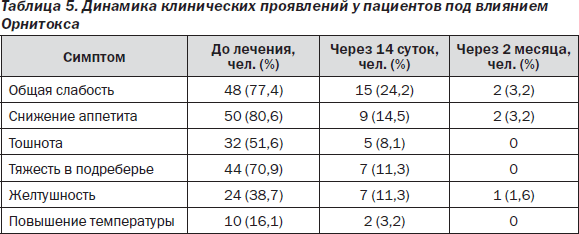
Кроме того, в процессе лечения препаратом Орнитокс у пациентов была отмечена хорошая динамика клинических симптомов (табл. 5).
Дополнительно следует отметить хорошую переносимость лечения как в основной, так и в контрольных группах. В основной группе только в первые дни лечения небольшая часть пациентов жаловалась на незначительную тошноту во время инфузии и в течение 1–1,5 часа после нее. В остальном побочных эффектов для применявшихся доз препаратов зафиксировано не было.
Таким образом, наш опыт показал, что метаболический гепатопротектор L-орнитина-L-аспартат (Орнитокс) может с высокой эффективностью использоваться при лечении пациентов с поражениями печени токсического генеза и среди исследованных гепатопротекторов является препаратом выбора с точки зрения восстановления детоксикационной функции гепатоцитов.
Выводы
1. Двухмесячный курс лечения препаратом Орнитокс в исследуемой группе пациентов с токсическим гепатитом средней степени тяжести привел к достоверному улучшению биохимических показателей, положительной клинической динамике и улучшению детоксикационной функции печени.
2. Достоверного улучшения детоксикационной функции печени при лечении силимарином и эссенциальными фосфолипидами не произошло, что ставит под сомнение обоснованность их применения в качестве гепатопротекторов у данной категории пациентов.
3. Орнитокс действует эффективнее по сравнению как с эссенциальными фосфолипидами, так и с силимарином, и его применение в лечении пациентов с токсическими гепатитами предпочтительнее.
1. Голубчиков М.В. Статистичний огляд захворюваності населення України на хвороби печінки та жовчовивідних шляхів // Сучасна гастроентерологія і гепатологія. — 2000. — № 2. — С. 53-55.
2. Кляритская И.Л. и др. Диагностическая ценность 13С-метацетинового дыхательного теста при некоторых хронических диффузных заболеваниях печени // Сучасна гастроентерологія. — 2006. — № 5(31). — С. 4-8.
3. Шипулин В.П., Михнева Н.Н., Чернявский В.В. Диагностические возможности применения 13С-метацетинового теста у больных хроническими диффузными заболеваниями печени // Лабораторная диагностика. — 2001. — № 1. — С. 37-40.
4. Шипулін В.П., Чернявський В.В., Міхньова Н.М. Спосіб оцінки ступеня порушення детоксикаційної функції печінки: Деклараційний патент № 62790 А, бюлетень № 12 від 15.12.2003.
5. Bjornsson E. Drug-induced liver injury: Hy’s rule revisited // Clin. Pharmacol. Ther. — 2006. — 79. — 521.
6. Lieber C. Alcoholic liver disease: new insight in pathogenesis lead to new treatments // J. Hepatol. — 2000. — Vol. 32, № 1 (suppl.). — P. 113-128.
7. Navarro V.J., Senior J.R. Drug-related hepatotoxicity // N. Engl. J. Med. — 2006. — 354. — 731.
8. Petrolati D. Festi, De Berardinis G., Colaiocco-Ferrante L., Di Paolo D., Tisone G. & Angelico M. 13C-methacetin breath test for monitoring hepatic function in cirrhotic patients before and after liver transplantation // Alimentary Pharmacology and Therapeutics. — 2003. — 18, 8. — 785-790.
9. Polson J., Lee W.M. AASLD Position Paper: The Management of Acute Liver Failure // Hepatology. — 2005. — 41. — 1179.
10. Sherlock S., Dooley J. Diseases of the Liver and Biliary system. — 10th edition. — 1997. — P. 385-400.
11. Tome S., Lucei M.R. Review article: current management of alcoholic liver disease // Aliment. Pharmacol. Ther. — 2004. — Vol. 19(7), № 1. — P. 707-714.
12. Zhang F.K., Zhang J.Y., Jia J.D. Treatment of patients with alcoholic liver disease // Hepatobiliary Pancreat. Dis. Int. — 2005. — № 4(1). — Р. 12-17.