Газета «Новости медицины и фармации» 18(341) 2010
Вернуться к номеру
Особенности применения α-адреноблокаторов у неврологических пациентов с ДГПЖ
Авторы: В.В. Спиридоненко, Луганский государственный медицинский университет
Версия для печати
Сложная и актуальная проблема терапии мозговых инсультов (МИ) требует пристального внимания со стороны врача [2, 3]. Одними из наиболее серьезных и социально значимых в клинике и лечении МИ являются расстройства акта мочеиспускания. Особенностью эпидемиологии мозговых инсультов является возрастной ценз — подавляющее большинство случаев приходится на средний и пожилой возраст, что совпадает с высокой частотой встречаемости нарушений акта мочеиспускания.
Основными клиническими проявлениями урологической патологии у мужчин пожилого и среднего возраста являются симптомы нижних мочевых путей (СНМП) [1]. По данным НИИ урологии АМН Украины, в настоящее время имеется незначительная тенденция к повышению регистрации случаев патологий простаты [7].
Данная статистика украинских ученых практически аналогична мировым данным. Так, при обследовании 2000 мужчин в США было выявлено, что у 25 % больных в возрасте от 40 до 49 лет и у 46 % мужчин от 70 до 79 лет имелись умеренные или тяжелые проявления СНМП [8]. Считается, что тяжесть симптомов с возрастом медленно прогрессирует. В различной медицинской литературе СНМП описаны как проявления различных патологических состояний (простатит, доброкачественная гиперплазия простаты, рак простаты, усиление сокращения гладких мышц простаты, инконтиненция мочевого пузыря и т.п.).
СНМП делятся на императивные (стихийные насильственные позывы к микции) и обструктивные (затруднение оттока мочи) проявления. Потеря мочи происходит по различным причинам как органического, так и нейрогенного характера. Основными патологическими процессами, происходящими в предстательной железе (ПЖ) у лиц среднего и старшего возраста, являются хроническое воспаление и гиперпластические процессы. Воспалительные процессы в простате часто возникают у лиц молодого возраста, имеют уретрогенный инфекционный генез (половые инфекции, бактерии, вирусы, грибы). Воспалительные изменения в ткани ПЖ, как правило, детерминированы инфекционным агентом, однако существуют и другие условия развития воспаления в простатической ткани. Это аномалии строения и структуры ПЖ (выявить которые практически невозможно), врожденные особенности кровообращения малого таза и простаты, нарушения нейротрофического обеспечения ПЖ на фоне неврологической патологии (рефлекторный мочевой пузырь, детрузорно-сфинктерная диссинергия).
Существовавшее ранее мнение о том, что у лиц с простатитом аденома или рак простаты не возникает, не находит абсолютно никакого подтверждения. По современным данным, именно воспалительный процесс в ПЖ является фоном для развития пролиферативных процессов.
Таким образом, мужчины в возрасте свыше 55 лет с СНМП в подавляющем большинстве случаев уже имеют хронический воспалительный процесс в простате, именуемый хроническим простатитом (ХП). По мировым данным, в большинстве случаев ХП является абактериальным и диагноз часто устанавливается на основании жалоб пациента, из которых СНМП являются ведущими [5].
Клиника обострения ХП в большинстве случаев проявляется СНМП, часто без выраженного болевого симптома. Локализация патологического процесса в простатическом отделе уретры и связанные с этим ирритативные и обструктивные расстройства мочеиспускания проявляются клиникой, очень сходной с проявлением цистита. Это влечет за собой неправильный диагноз, выставленный на этапе оказания неспециализированной помощи. Таким образом, у мужчин с наличием СНМП диагноз «цистит», как правило, неправомочен. Проводимое при этом лечение должно включать антибиотики, уросептики, неспецифические противовоспалительные препараты, α-адреноблокаторы, отвары мочегонных трав и т.д. Целью такой терапии будет ликвидация воспалительного процесса, нормализация всех составляющих акта мочеиспускания и профилактика острой ретенции мочи. Ликвидация развившейся оcтрой задержки мочи будет заключаться в установке катетера Фоллея в мочевой пузырь на несколько дней, применении вышеуказанной терапии с упором на селективные α-адреноблокаторы.
Известной и сложной проблемой современной урологии является доброкачественная гиперплазия предстательной железы (ДГПЖ).
Присоединение выраженного обструктивного компонента мочеиспускания у лиц после 60 лет клинически характеризует формирование ДГПЖ. Данное заболевание выражается в гипертрофии тканей простаты, чувствительных к влиянию тестостерона (процесс начинается с парауретральных желез). Гипертрофическая перестройка последних приводит к деформации и сужению простатического отдела уретры с соответствующей клиникой. Нарушение работы детрузора, эвакуаторной и накопительной функции мочевого пузыря приводит к развитию хронической ретенции (задержки) мочи.
Некоторыми факторами, непосредственно относящимися к проблеме нарушения акта мочеиспускания у пожилых мужчин, являются:
— возрастные нарушения сна из-за имеющихся эпизодов никтурии;
— возрастная тенденция к повышению выделения мочи в ночное время;
— нарастание гиперактивности детрузора, снижение контроля над емкостью пузыря и эвакуацией мочи;
— высокая вероятность сочетания расстройств в виде гиперплазии простаты и неврологических (нейрогенных) поражений структур мочевого пузыря;
— повышение экспрессии α1-адренорецепторов в сосудистом русле человека с возрастом [12];
— высокий уровень развития сосудистых катастроф головного мозга у лиц мужского пола на фоне повышения артериального давления.
Современный модус терапии ДГПЖ склоняется к четкой объективизации в установлении состояния заболевания, его осложнений и более широком использовании консервативной терапии данного заболевания. Наиболее достоверный эффект получен при использовании α1-адреноблокаторов — современной группы препаратов первого ряда при лечении ДГПЖ. Решающую роль при этом имеют выраженность субъективной клиники, стадия ДГПЖ, соматический статус больного, длительность анамнеза заболевания. По данным мировой литературы и НИИ урологии АМН Украины, использование α1-адреноблокаторов позволяет сократить число пациентов, требующих оперативного лечения, за счет эффективной и долгосрочной консервативной терапии [1, 8]. Лидером данной группы является тамсулозин — простатоселективный препарат с преимущественным влиянием на α1А-адренорецепторы, составляющие до 70 % от всех α1-адренорецепторов в простате и до 40 % — в мочевом пузыре [6, 8]. Эффективность препарата выражается также в улучшении биоэнергетики детрузора, восстановлении его сократительной способности, антирефлюксном (внутрипростатические рефлюксы) эффекте в простатических протоках [6].
Клиника СНМП может быть как различной степени тяжести, так и различного генеза. Во-первых, нарушение акта мочеиспускания проявляется острой задержкой мочи на фоне развившегося инсульта, когда в условиях проведения мер интенсивной терапии устанавливается уретральный катетер и возникает механическая травма слизистой. Последующее удаление катетера вызывает упорную дизурию (отек и травма слизистой уретры) и сопровождается симптомами хронической ретенции мочи. Во-вторых, у мужчин старше 60 лет, по статистике, наблюдается высокий уровень заболеваемости ДГПЖ, что является фоном для развития как хронической, так и острой ретенции мочи.
Развитие нарушения акта мочеиспускания у лиц с мозговым инсультом зависит от ряда факторов, многие из которых современной наукой не определены. СНМП, возникающие на фоне МИ как результат последнего, обусловлены нарушением работы в рефлекторной дуге регуляции мочеиспускания разного уровня [4]. Нарушение сигнализации из пораженных структур головного мозга, дискоординация работы автономной нервной системы мочевого пузыря (детрузорно-сфинктерные диссинергии) и ряд других условий (социальные, бытовые, личностные) обусловливают расстройство акта мочеиспускания у мужчин без видимой патологии простаты [10].
В случаях, когда у мужчины, перенесшего инсульт мозга, имеется ДГПЖ, проявления расстройства мочеиспускания часто имеют аналогичную выраженность симптомов, как при отсутствии МИ. В то же время на фоне МИ риск развития острой задержки мочи значительно возрастает, обструктивные симптомы становятся более выраженными, а функциональные резервы мочевого пузыря (за счет патологических спинальных влияний и хронической ретенции мочи) снижаются.
Помощь пациентам с МИ, имеющим СНМП, заключается в назначении групп препаратов, регулирующих акт мочеиспускания. Имеется достаточно большое количество групп препаратов, оказывающих действие на мочевой пузырь, однако наиболее эффективно улучшают состояние акта мочеиспускания и качество жизни пациента селективные α-адреноблокаторы.
Показаниями к назначению последних у мужчин старшего возраста являются следующие симптомы: увеличение частоты мочеиспускания, задержка мочи, ослабление потока мочи, ургентность (императивные позывы и необходимость немедленного освобождения мочевого пузыря) акта мочеиспускания и никтурия.
Использование антагонистов α1-ад- ренорецепторов в протоколах терапии СНМП, хронического простатита и ДГПЖ привело к качественно новым результатам лечения и накоплению опыта, позволяющего отсрочить оперативное лечение или избежать его. Кроме того, результаты, полученные в ходе мультицентровых исследований, показали, что облегчение СНМП назначением тамсулозина может оказаться более сложным, чем это считалось ранее. Доказана высокая вероятность влияния антагонистов α1-ад- ренорецепторов на СНМП за счет уменьшения возбудимости рефлекса мочеиспускания через рецепторы интрамурального ганглия мочевого пузыря или спинного мозга [10].
Эффективность тамсулозина объясняется блокированием α1А-адренорецепторов в простате с угнетением сократительной активности гладких мышц, улучшением динамики симптомов опорожнения и увеличением максимальной скорости потока мочи (Qmax). Существующий феномен селективности тамсулозина объясняется блокированием α1А- и α1D-адренорецепторов, повышением сократимости детрузора, уменьшением его нестабильности, смягчением симптомов ирритации и обструкции [13].
Также доказано, что выраженность расстройства мочеиспускания не зависит от размеров и массы ПЖ, поэтому у пациента с большой массой простаты (с морфологическими признаками ДГПЖ) могут быть умеренные или слабо выраженные СНМП, и наоборот. Важную роль играют состояние активности детрузора и состояние проходимости простатического отдела уретры. Так, при диффузных хронических простатитах, когда воспалительный процесс в парауретральной зоне простаты завершился формированием рубцов, СНМП будут выраженными и резистентными к проводимой терапии. Имеются данные о возможном уменьшении массы гипертрофированных структур мочевого пузыря (гиперплазия как результат отложения коллагена) на фоне лечения тамсулозином, хотя этой группе эффект уменьшения массы простаты и не присущ.
Имеются данные о феномене повышения с возрастом экспрессии α1-ад- ренорецепторов в сосудистом русле человека. Так, по данным исследования 500 кровеносных сосудов было установлено, что у лиц в возрасте более 65 лет плотность данных рецепторов внутренней грудной артерии увеличивалось до 9,4 фмоль/мг по сравнению с 4,4 фмоль/мг у лиц в возрасте менее 55 лет (р < 0,003). Плотность α1В-подтипа увеличивалась в 3 раза, и он лидировал среди подтипов в возрасте старше 65 лет, при этом плотность α1А-подтипа увеличилась в 1,5 раза. Это требует дальнейших исследований и указывает на факт того, что у пожилых лиц наилучшего эффекта можно достичь, применяя антагонисты, селективные к α1А-и α1D-адренорецепторам [14]. При исследовании было выявлено, что in vitro в тканях простаты человека регистрируется высокая α1-адренорецепторная антагонистическая активность при наличии в субстрате тамсулозина. Тамсулозин проявлял 10-кратную селективность к простате человека по сравнению с брыжеечными артериями. Тамсулозин и доксазозин при сравнении с брыжеечными артериями показали 2,5- и 0,28-кратную селективность к простате [9].
Таким образом, задача терапии состояний, связанных с СНМП, α-адреноблокаторами заключается в применении максимально селективного к структурам мочевого пузыря и простаты средства, исключающего влияние на другие системы, содержащие α-адренорецепторы. В условиях сосудистой мозговой катастрофы, часто происходящей на фоне артериальной гипертензии и атеросклероза сосудов головного мозга, особенно важной представляется проблема адекватной коррекции уровня артериального давления (АД). Большинство лиц данной возрастной категории получают антигипертензивную терапию, поэтому назначение α-адреноблокатора как средства, снижающего АД, требует подбора дозы.
Терапия неселективными α-адреноблокаторами начинается с титрования дозы, поэтому доксазозин назначают с 1–2 мг и постепенно доводят до 5, а иногда и 10 мг. Так же проводится подбор индивидуальной дозы альфузозина и теразозина. Крайне нежелательное наслаивание гипотензивных эффектов препаратов разных фармакологических групп особенно опасно у лиц, перенесших МИ. Опасность назначения неселективных α-адреноблокаторов пациентам с сосудистой патологией была доказана результатами широко известного исследования ALLHAT, в котором участвовали 42 448 пациентов старше 55 лет. Именно из-за значительного увеличения (на 25 %) числа случаев «комбинированных» кардиоваскулярных заболеваний и возрастания в 2 раза частоты развития сердечной недостаточности доксазозин был исключен из исследования [17]. При этом подчеркивалось, что результаты применения доксазозина могут быть распространены и на другие вазоактивные α-адреноблокаторы (празозин, теразозин и др.).
При атеросклерозе мозга и сосудистых мозговых нарушениях подбор дозы должен проводиться под строгим наблюдением врача, что в условиях амбулаторного ведения постинсультного периода крайне затруднительно. Отмечаемые у α-адреноблокаторов гипотензивные эффекты проявляются как симптоматическими, так и асимптоматическими гипотензивными эпизодами. Двойными слепыми рандомизированными исследованиями была установлена достоверно меньшая симптоматическая ортостатическая гипотензия при проведении тестов с ортостатической нагрузкой тамсулозином, чем с таковой теразозином [11]. Таким образом, из всех предлагаемых препаратов группы α-адреноблокаторов для пациентов, перенесших мозговой инсульт (так же как и группа риска с кардиальной патологией и сахарным диабетом), наиболее приемлемым является тамсулозин как препарат, селективный к α1А- и α1D-адренорецепторам [15, 16].
На протяжении 3,5 лет мы наблюдали 38 мужчин с клиникой мозгового инсульта и СНМП на почве ДГПЖ (средний возраст 70,2 ± 5,2 года). Давность возникновения инсульта — в среднем 3,3 ± 71,5 суток. Во всех случаях имела место хроническая ретенция мочи. Больные были поделены на 2 группы: I (n = 23) — получавшие Флосин® («Берлин-Хеми, Менарини Групп») и II — получавшие доксазозин в дозе 5 мг/сут утром (n = 15). Терапия доксазозином и Флосином® в дозе 0,4 мг/сут на протяжении 3 месяцев проводилась на фоне интенсивной терапии основного заболевания. Все пациенты получали антигипертензивную терапию (антагонисты кальциевых каналов, ингибиторы АПФ, мочегонные и т.п.). Эффективность лечения учитывалась по шкале оценки состояния мочеиспускания (IPSS) и показателям качества жизни (QоL). В обеих группах данные IPSS и QоL к 3-му месяцу лечения достоверно улучшились. При этом тамсулозин обеспечивает не только быстрое, но и стойкое избавление от симптомов ДГПЖ. И подтверждением этого являются результаты 6-летнего исследования, проведенного в 4 медицинских центрах Калифорнии, когда наиболее значительное улучшение симптоматики по сравнению с исходным уровнем наблюдалось в течение первого года лечения (–8,1 балла АУА) и сохранялось в течение всех 6 лет наблюдения (до –10,9 балла через 6 лет).
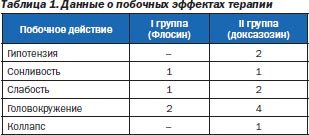
Из побочных действий наиболее существенными мы считали влияние α1-ад- реноблокатора на артериальное давление (АД) и развитие ортостатических реакций. В отличие от лиц I группы (с Флосином®), где побочные эффекты были минимальными, у лиц II группы (с доксазозином) отмечалось достоверное снижение АД, обусловленное блокадой α1-адренорецепторов с утратой контроля над механизмами сосудистой регуляции при переходе из клиностаза в ортостаз, снижением венозного оттока и сердечного выброса.
Это потребовало дополнительных усилий и времени для титрования дозы или перехода на селективный α-адреноблокатор (табл. 1). Напротив, Флосин® назначается без титрации, после проведения стандартного обследования, в дозе 0,4 мг в сутки. Препарат не опасен в плане эффекта первой дозы, состоящего в резком падении АД сразу после начала лечения и характерного для доксазозина и теразозина. Важно отметить, что исследования по применению тамсулозина у больных с различной соматической патологией показали, что для пациентов с умеренными нарушениями функции печени и почек тоже не требуется корректировка дозы. Сроки терапии вариабельны — от 10 дней до нескольких месяцев или лет.
Таким образом, на основании проведенного нами исследования можно заключить, что для пациентов с ДГПЖ, перенесших мозговой инсульт, препаратом выбора является уроселективный Флосин®, который обеспечивает быстрое и стойкое избавление от симптомов ДГПЖ при минимальных кардиоваскулярных побочных эффектах.
1. Возіанов О.Ф., Стаховський Е.О., Білик В.І. Деякі питання діагностики доброякісної гіперплазії передміхурової залози // Урологія. — 1999. — № 2. — С. 45-48.
2. Волошин П.В., Мищенко Т.С. Профилактика мозгового инсульта // Здоров’я України. — 2002. — № 5. — С. 14.
3. Дзяк Л.А., Мизякина Л.В. Мнестические нарушения в неврологической практике: Метод. рекомендации. — Днепропетровск, 2005. — 23 с.
4. Лебедев А.А., Гапеева Л.С. Внимание и ассоциативная память у больных с последствиями ишемического инсульта // Журн. неврол. и психиатр. им С.С. Корсакова. — 1992. — Т. 92, вып. 1. — С. 7-10.
5. Лопаткин Н.А., Аполихин О.И., Сивков А.В. и соавт. Результаты монотерапии теразозином (корнам) больных хроническим неинфекционным простатитом // Урология. — 2002. — № 5 (приложение). — С. 37-51.
6. Пушкарь Д.Ю., Белоусов Ю.Б., Раснер П.И. и соавт. Исследование степени уроселективности препарата Омник (тамсулозин) и его генерических аналогов // Здоровье мужчины. — 2009. — № 4. — С. 20-23.
7. Сайдакова Н.О., Старцева Л.М., Кравчук Н.Г. Основні показники урологічної допомоги в Україні за 2005–06 рік (Відомче видання). — Київ, 2007. — 205 с.
8. Chute C.G., Pancer L.A., Girman C.J. et al. The prevalence of prostatism: a population-based survey of urinary symptoms // J. Urol. — 1993 Jul. — 150. — 85-89.
9. Davis B.J., Noble A., Chappie C.R. et al. Human prostate-artery selectivity of tamsulosin, doxazosin and alfuzosin // Br. J. Pharmacjl. — 2000. — 129 (Suppl. 52). — P. 52.
10. Lyseng-Williamson K.A., Jarvis B., Wagstaff A.J. Тамсулозин. Новые данные относительно его роли в лечении симптомов нижних мочевых путей: пер. с англ. // Drugs. — 2002. — Vol. 62 (1). — P. 135-167.
11. deMay C., Michel M.C., McEwen J. et al. A double-blind comparison of terazosin and tamsulosin on their differential effects on ambulatory blood pressure and nocturnal orthostatic stress testing // Eur. Urol. — 1998. — Vol. 33. — P. 481-488.
12. Perlberg S., Caine M. Adrenergic response of bladder muscle in prostatic obstruction: its relation to detrusor instability // Urology. — 1982. — Vol. 20. — P. 524-527.
13. Price D.T., Schwinn D.A., Lomas- ney J.W. et al. Identification, quantification and localization of mRNA for three distinc α1-adrenergetic receptor subtypes in human prostate // J. Urol. — 1993. — 150. — 546-51.
14. Rudner X.L., Вerkowitz D.E., Booth J.V. et al. Subtype specific regulation of human vascular α1-adrenergetic receptors by vessel bed and age // Circulation. — 1999 Dec. 17. — 100. — 2336-43.
15. Smith M.S., Schambra U.B., Wil- son K.H. et al. α1-Аdrenergetic receptors in human spinal cord: specific localized expression of mRNA encoding α1-adrenergetic receptor subtypes at four distinct levels // Mol. Brain Res. — 1999. — 63. — 254-61.
16. Wilde M.I., McTavish D. Tamsulosin: a review of its pharmacological properties and therapeutic potential in the management of of symptomatic binign prostatic hyperplasia // Drugs. — 1996. — 52. — 883-98.
17. Diuretic versus alpha-blocker as first-step antihypertensive therapy: final results from the Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) // Hypertension. — 2003. — 42. — 239-46.
