Газета «Новости медицины и фармации» Кардиология (327) 2010 (тематический номер)
Вернуться к номеру
Системная красная волчанка и беременность
Авторы: А.Э. Багрий, А.И. Дядык, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней, общей практики и семейной медицины (заведующий — заслуженный деятель науки и техники Украины, д.м.н., проф. А.И. Дядык
Версия для печати
Системная красная волчанка (СКВ) в подавляющем большинстве случаев развивается у женщин репродуктивного возраста, в связи с чем проблема взаимоотношения данного заболевания с беременностью представляется чрезвычайно актуальной. По данным M . E . B . Clowse et al . (2008), М. Petri (2006), частота СКВ при гестации составляет 1 случай на 1500–3000 беременностей, причем в 20 % наблюдений диагноз впервые устанавливается в гестационном периоде. Указывается, что у 10–20 % больных СКВ признаки заболевания впервые выявляются в течение гестации или первых двух месяцев после родоразрешения (прерывания беременности). Высказывается точка зрения об определенной связи развития СКВ с беременностью или ранним послеродовым периодом, которая в исследованиях некоторых специалистов не получает подтверждения.
Вопросы взаимного влияния СКВ и беременности интенсивно изучаются в последние десятилетия, однако до настоящего времени эта проблема еще далека от разрешения, а результаты изучения ее различных аспектов зачастую довольно противоречивы. Сложность адекватной оценки обоюдного влияния гестации и СКВ связывают с серологической и клинической неоднородностью последней, ремиттирующим характером ее естественного течения, а также недостаточной изученностью взаимодействия обусловленных СКВ и индуцированных беременностью изменений иммунной, коагуляционной, эндокринной и других систем. Так, развитие маточно-плацентарного комплекса и системные гормональные сдвиги, присущие беременности (изменения уровней эстрогенов, пролактина, простагландинов и др.), обусловливают возникновение многообразных иммунологических феноменов, которые препятствуют отторжению плода и трофобласта в ходе нормальной гестации и потенциально могут влиять на течение СКВ:
— увеличение уровней Th -2-цитокинов, включая интерлейкины IL -4, IL -6, IL -10;
— снижение продукции IL -2;
— уменьшение активности NK -лимфоцитов;
— снижение уровней и активности CD 4 + -клеток;
— увеличение концентраций общего гемолитического комплемента сыворотки.
Влияние беременности на течение СКВ
Публикации, посвященные изучению влияния беременности на течение СКВ, неоднозначны. Приводятся данные о повышении частоты и увеличении тяжести обострений заболевания, а также о возможности летальной активации СКВ в ходе беременности. По данным представленных в табл. 1 крупных проспективных исследований, частота обострений СКВ при гестации варьирует от 43 до 79 %. В то же время в других исследованиях не только не получено доказательств индукции беременностью активации СКВ, но отмечается возможность уменьшения активности заболевания в ходе гестации. Несмотря на учащение обострений СКВ при беременности, ухудшения отдаленного прогноза заболевания не выявляется.
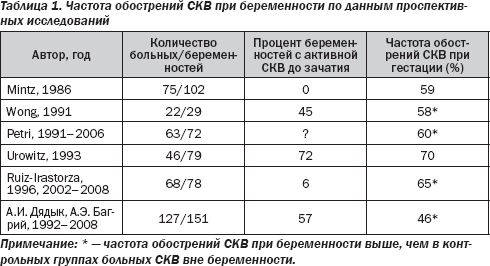
Важными представляются вопросы прогнозирования течения СКВ при беременности на основании оценки исходных параметров активности и клинических особенностей заболевания. Сведения, касающиеся характера течения СКВ в период беременности в зависимости от активности заболевания до зачатия, довольно противоречивы. В ряде исследований получены данные о небольшой частоте обострений СКВ при гестации, если зачатие наступило на фоне длительной (не менее 3–6 мес.) ремиссии. По данным ряда специалистов, при наличии клинических и серологических признаков активности заболевания к моменту зачатия в период беременности часто наблюдается отчетливая активация СКВ (табл. 1). В свою очередь, M . E . B . Clowse et al . (2008) считают, что наличие клинической ремиссии СКВ до наступления гестации ни в коей мере не может гарантировать от обострения заболевания при беременности.
Активация СКВ может наступать в различные сроки беременности (табл. 2). Обострения заболевания, по мнению одних специалистов, чаще наблюдаются в первой половине гестации, по мнению других — в III триместре, а по данным третьих, частота обострений СКВ не зависит от срока беременности. Довольно часто активация СКВ отмечается в течение первых 2–3 месяцев после родоразрешения или искусственного прерывания беременности.
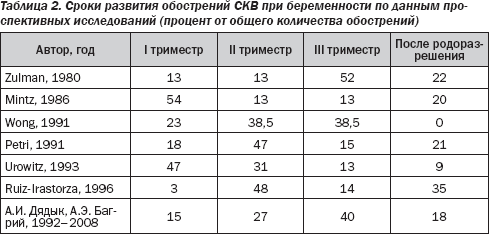
Развитие СКВ в ходе гестации или непосредственно после ее завершения обычно характеризуется бурным вовлечением в патологический процесс жизненно важных органов, клинически проявляющимся высокой активностью заболевания. Как и в случаях, не связанных с беременностью, адекватная терапия глюкокортикоидами обычно оказывает хороший клинический эффект и успешно контролирует активность процесса.
Вероятность активации СКВ и ее неблагоприятного течения в ходе беременности увеличивается при наличии до зачатия поражения почек, сердца, центральной нервной системы, легких. Обострения СКВ при гестации напоминают таковые у небеременных больных и характеризуются развитием или нарастанием классических клинических признаков заболевания, спектр и выраженность которых довольно широко варьируют.
Наиболее часто обострения СКВ при беременности проявляются увеличением активности кожных и мышечно-скелетных поражений. Обострения СКВ в ходе гестации более часто по сравнению с обострениями волчанки у небеременных характеризуются активацией ренальных, церебральных и гематологических (в первую очередь тромбоцитопении) поражений. Развитие обострений СКВ более вероятно при беременности у женщин, имеющих до зачатия активное течение заболевания, а также при наличии волчаночного гломерулонефрита (ВГН) (особенно активного) и поражений цнс . Крайне важной представляется своевременная диагностика обострения, что требует проведения регулярного врачебного наблюдения и самоконтроля (термометрия, исследование частоты пульса), контроля анализов мочи, функции почек и печени, измерения артериального давления, электро- и эхокардиографического контроля, проведения общеклинических анализов крови с изучением количества тромбоцитов, определения уровней антинуклеарных антител, иммуноглобулинов, компонентов комплемента, циркулирующих иммунных комплексов (ЦИК), регулярных осмотров терапевта, ревматолога, при необходимости также нефролога, невропатолога.
У больных СКВ довольно сложной представляется правильная интерпретация при гестации обычно применяемых серологических критериев активности заболевания, так как увеличение титров аутоантител, уровней ЦИК, снижение содержания комплемента сыворотки крови могут быть обусловлены влиянием гуморальных механизмов беременности — экспрессией аллогенных антигенов, увеличением уровней половых гормонов и др.
Влияние гестации на течение ВГН
Учитывая высокую частоту поражения почек при СКВ, особое место поражения почек в прогнозе заболевания, а также низкую эффективность глюкокортикоидной терапии (ГКТ) при ВГН, отдельного обсуждения заслуживают вопросы взаимоотношения ВГН и беременности. Приходится вновь констатировать противоречивость данных литературы по этому вопросу, что в определенной мере обусловлено неоднозначным подходом исследователей к диагностике и лечению ВГН, отсутствием в ряде случаев полноценного обследования до зачатия (целенаправленные исследования мочи, функции почек, установление морфологических особенностей ВГН, параметров серологического профиля и др.).
По мнению подавляющего большинства исследователей, наличие ВГН до зачатия или развитие его в ходе беременности обычно указывает на серьезный прогноз. При этом отмечается, что риск обострения ВГН и его неблагоприятное течение возрастают при наличии до зачатия активного гломерулонефрита, артериальной гипертензии и нарушения функции почек. В то же время подчеркивается труднопредсказуемость течения ВГН в гестационном периоде, возможность развития обострений в случаях неактивного ВГН, а также при отсутствии артериальной гипертензии и при сохранной функции почек. В этой связи особую значимость при гестации приобретает целенаправленный, постоянный, тщательный динамический контроль за клиническими проявлениями ВГН с обязательным исследованием функции почек.
Течение ВГН в ходе беременности нередко сопровождается увеличением уровней протеинурии, иногда достигающих нефротических величин. Некоторые специалисты полагают, что нарастание протеинурии во время гестации не всегда отражает активацию заболевания и довольно часто обусловлено индуцированными беременностью феноменами (увеличением количества профильтрованного белка, связанным с возрастанием клубочковой фильтрации; повышением давления в почечных венах в поздние сроки гестации). В таких ситуациях после родоразрешения наблюдается снижение протеинурии до фонового уровня. Отсутствие регрессии протеинурии после родоразрешения свидетельствует об обострении заболевания и является прогностически неблагоприятным фактором.
Важным клиническим признаком обострения ВГН при гестации (подобно таковому вне беременности) является нарастание уровней гематурии, зачастую сочетающееся с развитием экстракапиллярных и некротизирующих гломерулярных поражений. Вне обострений ВГН уровень гематурии в ходе беременности существенно не меняется.
У больных ВГН с сохраненной до зачатия функцией почек развития азотемии в ходе беременности обычно не наблюдается, хотя нередко, в отличие от здоровых беременных, снижения уровней сывороточного креатинина не происходит. В ряде случаев возможно развитие транзиторного или даже перманентного ухудшения почечной функции. После родоразрешения, а также после искусственного аборта (и реже — в ходе беременности) возможно развитие анурической острой почечной недостаточности, напоминающей послеродовую острую почечную недостаточность, обусловленную тромботической микроангиопатией.
При наличии у больных ВГН до зачатия почечной недостаточности довольно высока вероятность дальнейшего ее прогрессирования в ходе гестации.
У большинства больных ВГН с нормальными до зачатия величинами АД в период гестации развития артериальной гипертензии не наблюдается. В то же время у исходно гипертензивных больных довольно часто отмечается дальнейшее прогрессирование артериальной гипертензии в ходе беременности, причем после родоразрешения артериальное давление у некоторых пациенток возвращается к исходным уровням, у других может наблюдаться прогрессирование гипертензионного синдрома. В ряде случаев при ВГН возможно развитие злокачественного характера течения артериальной гипертензии, что характеризуется возникновением тяжелых сосудистых осложнений.
По мнению M . Petri et al . (2006), оценка до беременности морфологической картины почек при ВГН может служить важным критерием прогнозирования течения заболевания в ходе гестации. Беременность у больных ВГН при наличии диффузных пролиферативных изменений (присущих IV классу ВГН) в почках некоторые исследователи считают противопоказанной. В то же время в других исследованиях не выявлено отчетливой связи между тяжестью гистологических изменений в почках при ВГН до зачатия и особенностями течения заболевания при беременности. В единичных сообщениях показана возможность отчетливого ухудшения морфологической картины ВГН (переход очагового пролиферативного гломерулонефрита ( III класс) в диффузный ( IV класс) в ходе гестации.
Влияние СКВ на течение и исход гестации
Присущие СКВ иммунопатологические механизмы, нарушения эстрогенного метаболизма, коагулопатии, тромбоцитопатии, различные висцериты приводят к высокой частоте развития у беременных спонтанных абортов, мертворождений, недоношенности и гипотрофии новорожденных, высокой перинатальной смертности, а также к увеличению числа случаев аномалий родовой деятельности и кровотечений в родах. Высокий риск развития гестационных осложнений при СКВ определяет важность тщательного планирования беременности, прогнозирования ее течения и исхода. В ходе беременности значительное внимание следует уделять мониторной оценке состояния матери и плода, а при необходимости — выбору адекватной терапии. Весь комплекс проблем следует решать совместно акушерам, ревматологам, нефрологам, иммунологам и неонатологам.
Характер течения и исход гестации в значительной мере зависят от степени активности СКВ и ее клинических особенностей, выявляемых до зачатия. При наличии клинических и серологических признаков активности СКВ течение беременности и ее исход менее благоприятны, чем в случаях, когда беременности предшествует длительная ремиссия заболевания. Неблагоприятными считаются ситуации, когда СКВ начинается во время беременности.
Наличие до зачатия активного ВГН, протекающего с высокой протеинурией, и/или артериальной гипертензией, и/или нарушением функции почек, рассматривается как неблагоприятный фактор фетального прогноза. При неактивном ВГН нередки случаи неосложненной беременности.
У беременных с СКВ имеет место высокий риск развития позднего токсикоза, клиническая картина которого близка к таковой при обострении ВГН. По мнению M . Petri et al . (2006), в этих ситуациях единственным достоверным дифференциально-диагностическим критерием может служить гистологическое исследование почечной ткани. Различная тактика ведения больных с поздним токсикозом (симптоматическая терапия, а при тяжелых формах — прерывание беременности) и с обострениями ВГН (активная патогенетическая терапия) обусловливает практическое значение правильной и своевременной диагностики этих патологических состояний.
Вероятность возникновения различных акушерских и неонатальных осложнений при СКВ довольно высока. В развитии этих осложнений важная роль отводится присущим СКВ иммунным дисфункциям, которые могут явиться причиной нарушения нормального иммунного симбиоза между плодом и матерью, вследствие чего плацента и плод становятся мишенями атаки иммунной системы матери. При этом существенную роль играют уменьшение адекватной продукции блокирующих антител, недостаточность супрессорных механизмов, снижение уровней Т-хелперов, депозиция в плаценте иммунных комплексов. Важное значение придается противоплацентарной агрессии материнских аутоантител и их трансмиссии в плодовую циркуляцию. Следствием описанных нарушений может быть развитие различных осложнений беременности. Иммунологическими предикторами осложнений беременности при СКВ признаются выявляемые в крови трофобластреактивные лимфоцитотоксические антитела, а также антитела к фосфолипидам (АФЛ), гладкой мускулатуре, растворимым антигенам тканевых рибонуклеопротеинов.
Антифосфолипидный синдром и беременность
Наличие тесной связи между частотой развития гестационной патологии и наличием в сыворотке АФЛ послужило основанием для углубленного изучения этого вопроса. АФЛ, к которым относят волчаночный антикоагулянт, антитела к кардиолипину, антитела, ответственные за появление ложноположительной реакции на сифилис, представляют собой IgG или IgM и выявляются у 5–26 % больных СКВ и реже при некоторых других патологических состояниях. Взаимодействуя с фосфолипидами мембран тромбоцитов, клеток эндотелия сосудов, нейронов и других клеток, они индуцируют развитие дисбаланса между простациклином и тромбоксаном А2. Появление АФЛ в сыворотке может сопровождаться венозными и/или артериальными тромбозами, тромбоцитопенией, неврологической симптоматикой, акушерской патологией. Преэмбриональные и эмбриональные прерывания беременности, самопроизвольные аборты и внутриутробная гибель плода являются классическими проявлениями антифосфолипидного синдрома (АФС). Кроме того, наличие АФС характеризуется увеличением частоты развития преэклампсии, преждевременных родов и дистресс-синдрома новорожденных. А фс у матери приводит к выраженным изменениям плаценты, включая виллиты, васкулопатию спиральных артерий плаценты, их тромбозирование и некрозы плаценты. Как первичный АФС, так и АФС при СКВ является одной из ведущих причин развития венозных и артериальных тромбозов (в том числе сопровождающихся мозговыми катастрофами) у женщин во время беременности и в послеродовом периоде. У пациенток с СКВ в ходе гестации и после ее завершения описано развитие катастрофического АФС с полиморфными тромботическими и васкулопатическими проявлениями. Представлены данные о том, что наиболее высокий риск осложнений беременности имеет место у женщин с антителами к кардиолипину класса i g g .
Возникновение осложнений беременности у больных СКВ с АФЛ связывают с угнетением продукции простациклина в организме матери и плода, а также с повреждением фосфолипидных структур эндотелиоцитов плаценты. Эти процессы нарушают развитие плаценты, ингибируют ее трансмиссионную способность и индуцируют развитие в ней и в сосудистом русле плода тромботических и инфарктных изменений.
Наличие АФЛ в сыворотке крови беременных ассоциируется со значительным риском развития позднего токсикоза, рекуррентных спонтанных абортов и внутриутробной гибели плода. У АФЛ-позитивных женщин при отсутствии лечения лишь 9 % беременностей заканчиваются рождением живых детей. Ряд авторов считает АФЛ ответственными за возникновение некоторых случаев хореи беременных, интра- и постпартальных тромбоэмболий. Прохождение через плаценту АФЛ, относящихся к I gG, может быть причиной развития тромботических нарушений у новорожденных.
Синдром волчанки новорожденных
Около 3 % новорожденных от матерей с СКВ демонстрируют клинические проявления синдрома волчанки новорожденных (ВН), в связи с чем считаем важным остановиться на некоторых механизмах возникновения и клинических проявлениях данного синдрома. В развитии ВН важную роль играют трансплацентарный пассаж и поступление в плодовую циркуляцию относящихся к IgG патологических материнских антител к растворимым антигенам тканевых рибонуклеопротеинов — 48 kD SSB / La , 60 kD SSA / Ro и особенно 52 kD SSA / Ro . Эти аутоантитела встречаются у 25–30 % больных СКВ. Показана их тропность к ткани проводящей системы сердца плода и способность индуцировать развитие фиброза в эндо- и миокарде, в том числе в области атриовентрикулярного соединения. Сообщается также о возможности развития фиброза других органов при экспозиции Ro ( SS -А)- и La(SS-В)-антител. Установлена высокая ассоциация ВН с HLA DR З — фенотипом матери. Через 4–12 нед. после рождения происходит элиминация материнских иммуноглобулинов из организма ребенка, что сопровождается исчезновением ряда клинических проявлений ВН.
Клинические признаки ВН, включающие кожные поражения, цитопении, пневмониты, гепатолиенальный синдром, миокардиты и перикардиты, обычно имеют транзиторный характер и в 9 раз чаще встречаются у девочек, чем у мальчиков. Среди транзиторных проявлений ВН поражения кожи встречаются наиболее часто и представлены анулярными четко очерченными, иногда сливными эритематозными с шелушением по краям высыпаниями, имеющими типичную микроскопическую картину волчаночного поражения кожи и локализующимися преимущественно на лице и верхней части груди. Подобные дермальные признаки ВН обычно исчезают в течение первого года жизни. Другие транзиторные проявления ВН встречаются значительно реже, характеризуются умеренной степенью выраженности и быстропреходящи. Как отмечалось ранее, продолжительность транзиторных клинических признаков ВН определяется сроком клиренса материнских IgG из крови ребенка.
Перманентная симптоматика ВН, характеризующаяся врожденной атриовентрикулярной блокадой (ВАВБ) с наличием или отсутствием структурных аномалий сердца (врожденных пороков сердца), выявляется у 35–50 % больных ВН. При этом такие клинические проявления в 1,6 раза чаще встречаются у мальчиков, чем у девочек. Нарушение атриовентрикулярной проводимости — ВАВБ — при ВН может быть полным или неполным и в 25 % наблюдений ассоциируется с септальными дефектами, и/или незаращением артериального протока, и/или транспозицией крупных сосудов. ВАВБ — серьезное клиническое проявление ВН и может в части случаев служить причиной фетальной или неонатальной смерти. При отсутствии сопутствующих дефектов (в частности, врожденных пороков сердца) 20-летняя выживаемость при ВАВБ составляет 95 % .
Важная роль отводится раннему (еще при гестации) выявлению В A ВБ с целью определения оптимальной тактики ведения беременности и родов. При СКВ исследования на наличие антител к 48 kD SSB / La , 60 kD SSA / Ro и особенно к 52 kD SSA / Ro должны проводиться как в максимально ранние сроки беременности, так и в сроки гестации, составляющие 18–20 нед. Для своевременного выявления брадикардии у плода (менее 60–70 сердечных сокращений в минуту) показано проведение абдоминального ультразвукового исследования и фетальных нестрессовых тестов, а после
28 нед. — фетальной эхокардиографии. Информативность электрокардиографического исследования у плода невелика, а результаты его зачастую не отражают реальную картину. Поскольку ВАВБ часто сочетается с миокардитом, то для уменьшения нагрузки на сердце плода рекомендуется как можно дольше сохранять окружение in utero . При описываемом сочетании ВАВБ с миокардитом наблюдение за частотой фетального сердечного ритма не отражает реальный оксигенационный статус плода, в связи с чем рекомендуется наблюдение за плодом с помощью рН-регистрирующих систем. Некоторые авторы для устранения фетального дистресса рекомендуют кесарево сечение.
Возможность подавления продукции Ro ( SS -А)- и La ( SS -В)-антител, а также улучшения клинической картины при ВАВБ под влиянием глюкокортикоидной терапии у беременных с СКВ не доказана. Предполагают, что достижению положительного клинического и серологического эффекта способствует проведение плазмафереза.
Сообщается, что рождение детей с ВАВБ возможно у Ro ( SS -А)- и La(SS-В)-позитивных женщин без клинических признаков СКВ. У части таких женщин в последующем наблюдается развитие развернутой клинической картины СКВ, что обусловливает необходимость тщательного наблюдения за всеми женщинами, у детей которых имеет место ВАВБ.
Стратегические подходы к ведению СКВ при гестации
Большое внимание уделяется планированию беременности у больных СКВ и тактике ведения таких женщин в гестационном периоде. Степень материнского и плодового риска должна устанавливаться до зачатия, поскольку в ходе беременности как решение этих вопросов, так и предотвращение или надлежащая коррекция развивающихся осложнений сопряжены с большими трудностями. Желательным признается наличие ремиссии заболевания в течение не менее 4–6 месяцев до предполагаемого зачатия. Следует учитывать, что искусственный аборт не всегда улучшает прогноз у женщины и может способствовать развитию обострения заболевания, однако при высоком риске осложнений некоторые авторы считают аборт возможным.
Подбор адекватных лечебных программ в ходе гестации зачастую представляет сложную задачу. В целях контроля активности СКВ во время беременности наиболее часто применяют нестероидные противовоспалительные препараты и глюкокортикоиды, реже — противомалярийные и цитотоксические средства. Подходы к выбору и тактике применения перечисленных препаратов при гестации принципиально не отличаются от таковых вне беременности. Указанные препараты способны индуцировать различные фетальные осложнения, в связи с чем подчеркивается необходимость выбора наименее опасных для плода препаратов и их применения в наименьших адекватных дозировках. Полагаем важным остановиться на некоторых вопросах подбора лекарственных средств у беременных с СКВ и наиболее существенных негативных эффектах медикаментозной терапии.
Прежде чем рассматривать особенности использования различных групп патогенетических препаратов у беременных, считаем целесообразным напомнить читателю классификацию лекарственных препаратов при беременности, предложенную Департаментом пищевых и лекарственных продуктов ( FDA ) США , являющуюся в настоящее время общепринятой.
1. Категория А — препараты, для которых в контролируемых исследованиях риск для плода не установлен. Ни один из используемых в лечении СКВ противоревматических препаратов не может быть отнесен к категории А при гестации.
2. Категория В — препараты, для которых сведений о риске у беременных нет. К категории В FDA относит преднизолон/метилпреднизолон, а при использовании в I и II триместрах гестации также нестероидные противовоспалительные препараты (НПВП): индометацин, ибупрофен, напроксен.
3. Категория С — средства, для которых риск использования при беременности четко не определен (когда четкие данные у человека отсутствуют, а в исследованиях на животных зарегистрировано как наличие, так и отсутствие неблагоприятных эффектов у плода). К категории С при беременности относят аспирин, хлорохин, гидроксихлорохин, дексаметазон, циклоспорин А.
4. Категория D — препараты, для которых имеются свидетельства достоверного риска для плода (однако в ряде наблюдений благоприятный эффект препарата превышает возможный риск его применения). К категории D относят азатиоприн, хлорамбуцил, циклофосфамид, а при применении в III триместре беременности — индометацин, ибупрофен, напроксен.
5. Категория Х — препараты, противопоказанные при беременности (когда риск для плода в исследованиях у человека и животных превышает благоприятные эффекты препарата). К этой категории относят метотрексат.
В табл. 3 представлена общая характеристика лекарственных препаратов, используемых в лечении СКВ при беременности и лактации.
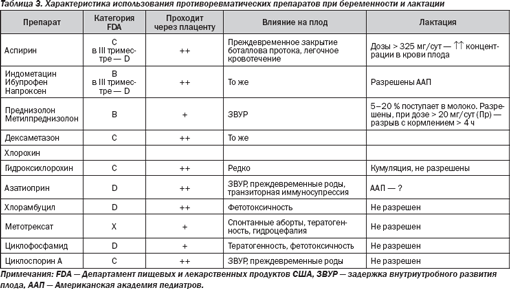
Нестероидные противовоспалительные препараты у беременных и кормящих
Вопросы использования НПВП при беременности и лактации представляются сложными и недостаточно изученными, а публикации, посвященные данной проблеме, включают единичные сообщения, отличающиеся противоречивостью. Актуальность обсуждаемой проблемы определяется высокой частотой использования беременными и кормящими различных НПВП, а также потенциальным риском развития побочных эффектов лекарственных препаратов этой группы на организм матери, плода и новорожденного.
По данным популяционных исследований, НПВП находят широкое применение у беременных, причем их прием при гестации носит зачастую бесконтрольный характер. В ряде сообщений представлены данные о том, что 21–32 % женщин в I триместре беременности используют различные НПВП. Обращают на себя внимание данные недавней работы M . A . Alano et al . (2008), в которой на основании исследования мекония показано, что 18,8–43,6 % новорож денных в течение II–III триместров гестации подвергаются экспозиции хотя бы одного НПВП, а около 10 % — двух и более препаратов этой группы. Столь частое использование НПВП при беременности связано с рядом факторов, включающих:
— повсеместное широкое применение НПВП с противовоспалительной, анальгетической и жаропонижающей целями в общей популяции;
— использование некоторых НПВП по акушерским показаниям (применение в части случаев низких доз аспирина для превентирования развития артериальной гипертензии, связанной с беременностью; использование индометацина и напроксена с токолитической целью);
— наличие НПВП в составе различных мультиингредиентных, широкодоступных препаратов (например, используемых при простудных заболеваниях);
— бесконтрольное распространение НПВП через коммерческую аптечную сеть;
— низкую информированность беременных, а также врачей о возможных неблагоприятных материнских, фетальных и неонатальных эффектах НПВП.
НПВП хорошо проникают через плаценту; период их полувыведения из организма плода, по экспериментальным и клиническим данным, по крайней мере не меньше периода полувыведения из организма матери. Потенциальные неблагоприятные эффекты НПВП на организм матери и плода рассматривают как группоспецифичные и связывают с их влиянием на синтез простагландинов и тромбоксана. К материнским неблагоприятным эффектам относят пролонгацию беременности и родов. Неблагоприятные эффекты НПВП на плод и новорожденного включают транзиторные нарушения процессов коагуляции, развитие дисфункции канальцевого аппарата почек, преждевременное закрытие артериального протока (сочетающееся в части случаев с утолщением мышечного слоя стенки артерий малого круга кровообращения) с формированием персистирующей пульмональной гипертензии новорожденных.
С учетом того, что вышеперечисленные побочные эффекты НПВП на мать, плод и новорожденного развиваются при использовании препаратов в поздние сроки гестации, в соответствии с существующими рекомендациями Американской и Британской ассоциаций акушеров, применение всех НПВП необходимо прекратить не менее чем за 8 недель до срока предполагаемых родов.
Оценке связи применения НПВП в ранних сроках гестации с развитием врожденных пороков развития у новорожденных посвящены крупные исследования. Так, Michigan Medical Study включало 1709 и 3178 случаев использования в I триместре беременности аспирина и ибупрофена соответственно. Исследование Collaborative Perinatal Project охватило 14 864 случая применения аспирина в I триместре гестации. В этих исследованиях не было отмечено тератогенных эффектов перечисленных препаратов, однако следует учесть, что оба препарата использовались при гестации в низких и умеренных дозировках. Обращают на себя внимание данные исследования Ericson A ( 2001 г .), где оценивались 2557 новорожденных, матери которых принимали различные НПВП в I триместре беременности. По сравнению с группой новорожденных от матерей, не принимавших НПВП при гестации, не было отмечено увеличения частоты врожденных дефектов развития. В то же время в «группе НПВП» отмечена тенденция к увеличению частоты врожденных пороков сердца и расщелин лица. Авторы отмечают, что среди 6 женщин, родивших детей с расщелинами лица, 5 принимали в I триместре гестации напроксен.
Наиболее изученным при гестации среди НПВП является аспирин. Его применение считается достаточно безопасным в I и II триместрах беременности. Не было представлено данных о наличии у препарата тератогенных и фетотоксических эффектов. Низкие дозы аспирина находили достаточно широкое использование при гестации в 90-х годах ХХ века с целью превентирования развития артериальной гипертензии, ассоциированной с беременностью; при этом не было отмечено его неблагоприятных эффектов на мать, плод и новорожденного. В немногочисленных сообщениях указывается, что в случае необходимости назначения аспирина беременным с СКВ для контроля суставного синдрома, с учетом его высокого метаболизма в плаценте, могут применяться довольно высокие дозировки — до 2–3 г/сутки и более, однако безопасность таких дозировок остается недостаточно четко установленной. Как и другие НПВП, аспирин следует отменять не менее чем за 8 недель до предполагаемого срока родоразрешения. FDA США относит аспирин к категории С. При лактации аспирин проникает в молоко в достаточно малых количествах и при дозировках до 325 мг/сутки разрешен Американской ассоциацией педиатров к использованию у кормящих матерей. Применение более высоких дозировок сопряжено с увеличенным риском для новорожденного.
Индометацин, ибупрофен и напроксен изучены при беременности в меньшей мере, чем аспирин. С учетом отсутствия достоверных свидетельств о наличии у этих препаратов тератогенного и фетотоксического потенциалов их можно использовать в I и II триместрах беременности в дозировках, не отличающихся от таковых для небеременных. В III триместре гестации их применение не рекомендуется. В соответствии с классификацией FDA США они отнесены к категории В в I и II триместрах и к категории D — в III триместре беременности.
По мнению ряда авторов, индометацин, ибупрофен и напроксен следует рассматривать при гестации как НПВП 2-го ряда. Их следует назначать в I и II триместрах при непереносимости аспирина или его недостаточной эффективности.
Индометацин и ибупрофен экскретируются в грудное молоко в незначительных количествах, в связи с чем разрешено их использование у кормящих матерей Американской ассоциацией педиатров. Данные о безопасности напроксена при лактации малочисленны и неоднозначны, в связи с чем его не следует применять в период кормления.
Безопасность таких НПВП, как диклофенак, фенопрофен, флюрбипрофен, кетопрофен, меклофеналат, пироксикам, сулиндак, кеторолак, нимесулид, мелоксикам, целекоксиб, при беременности и лактации остается неустановленной, в связи с чем в настоящее время их применение не рекомендуется.
Противомалярийные препараты
В 80-х и в начале 90-х годов противомалярийные препараты (ПМП) рассматривались как противопоказанные при гестации. В последующем при применении гидроксихлорохина не было получено данных о возникновении аномалий у плода, в том числе внутриутробных дефектов развития глаза. Кроме того, были представлены доказательства возможности отчетливого увеличения активности СКВ у беременных в случае отмены гидроксихлорохина. В этой связи в последние годы констатируется изменение отношения ведущих клиницистов к назначению ПМП при гестации у пациенток с СКВ. В настоящее время стратегия их использования в таких крупных центрах по изучению СКВ при беременности, как St. t homas L upus P regnancy C enter, l ondon, h opkins Lupus Pregnancy C enter, b altimore, usa, состоит в продолжении лечения гидроксихлорохином в случае, если больная СКВ принимала его до зачатия. Безопасность применения хлорохина при беременности остается неустановленной, в связи с чем его использование считается нецелесообразным.
Глюкокортикоиды при беременности
Доказательства развития тератогенных и фетотоксических эффектов на фоне применения глюкокортикоидов независимо от срока гестации отсутствуют. Из глюкокортикоидных препаратов предпочтение отдают преднизолону и метилпреднизолону, имеющим высокий плацентарный метаболизм. Применение дексаметазона и бетаметазона, характеризующихся низким плацентарным метаболизмом, считается нецелесообразным. Некоторые исследователи связывают развитие целого ряда акушерских и фетальных осложнений с применением глюкокортикоидной терапии у беременных с СКВ. Среди этих осложнений выделяют преждевременные роды, задержку внутриутробного развития плода, преждевременный разрыв плодных оболочек, развитие гипоальдостеронизма, снижения уровней кортизола сыворотки, маскулинизацию новорожденных девочек, увеличение частоты развития у матери артериальной гипертензии, остеопороза, гестационного сахарного диабета и аваскулярного некроза костей. Некоторые авторы не рекомендуют прибегать к естественному вскармливанию женщинам, получавшим в ходе беременности или продолжающим получать после родов высокие дозы глюкокортикоидов. В то же время высказывается мнение, что описанные фетальные нарушения могут быть обусловлены самим заболеванием, а не экспозицией глюкокортикоидов.
Азатиоприн хорошо проникает через плаценту, однако в печени плода отсутствует энзим инозинат пирофосфорилаза, трансформирующий азатиоприн в его активные метаболиты. Активные метаболиты азатиоприна плохо проникают через плаценту. Азатиоприн, используемый в лечении активной СКВ, при беременности рассматривается многими клиницистами как наиболее безопасный среди препаратов цитотоксического действия. В репрезентативных исследованиях у животных и человека он не показывал развития врожденных дефектов у плода. У новорожденных от женщин, получавших азатиоприн, зарегистрированы спорадические случаи полидактилии, врожденного стеноза клапана легочной артерии, гипотиреоза, дефекта межпредсердной перегородки, гипоспадии, однако их связь с приемом препарата четко не документирована. Применение азатиоприна у беременных требует контроля уровней лейкоцитов, тромбоцитов, показателей функции печени в I и II триместрах ежемесячно, в iii триместре — каждые 2 недели. У новорожденных обязательным является контроль уровней лейкоцитов и тромбоцитов крови. Азатиоприн и его метаболиты выделяются с молоком в умеренных количествах. Лактацию при применении препарата у матери следует прекратить.
Циклофосфамид. Значительно более жестким является подход к назначению при беременности циклофосфамида, что обусловлено высокой частотой развития неблагоприятных эффектов на плод . Применение циклофосфамида в I триместре беременности ассоциировано с развитием аномалий лица, лицевого скелета, внутренних органов, кожи и мышечно-скелетной системы у плода. Частота развития врожденных дефектов у плода при использовании циклофосфамида во II и III триместрах отчетливо ниже. У новорожденных, матери которых принимали препарат в ходе гестации, возможно развитие панцитопении. Применение циклофосфамида у больных СКВ при гестации категорически противопоказано и может быть оправдано во 2 и 3 триместрах только в случае наличия жизненных показаний со стороны матери, если контроль активности заболевания не может быть достигнут, несмотря на назначение высоких доз глюкокортикоидов (включая пульс-терапию) и азатиоприна. При планировании беременности по меньшей мере за 2 месяца до предполагаемого зачатия препарат следует отменить из-за риска мутагенного действия. Циклофосфамид категорически противопоказан при лактации.
Метотрексат категорически противопоказан при беременности из-за высокого риска фетотоксических эффектов и развития аномалий у плода, а также тяжелой миелодепрессии у новорожденных. При планировании беременности по меньшей мере за 2 месяца до предполагаемого зачатия метотрексат следует отменить, назначить прием добавок фолиевой кислоты, что продолжать в течение всей гестации. Препарат категорически противопоказан при лактации.
Хлорамбуцил категорически противопоказан при гестации из-за риска развития тяжелых аномалий у плода (агенезия почек и мочеточников, аномалии костей и сердечно-сосудистой системы), он также категорически противопоказан при лактации.
Циклоспорин. В ряде ситуаций, когда контроля высокой активности волчаночного процесса не удается достичь применением высоких доз (включая пульс-терапию) глюкокортикоидов и азатиоприна, для купирования жизнеопасных обострений СКВ может быть использован циклоспорин. Препарат проникает через плаценту, при его применении увеличена частота задержки внутриутробного развития плода, самопроизвольных абортов, преждевременных родов, тромбоцитопении, лейкопении, гипогликемии у плода, в единичных наблюдениях описаны катаракты и гипопаратиреоз у плода. Не представлено доказательств увеличения риска развития аномалий у новорожденных на фоне применения циклоспорина. Препарат экскретируется в грудное молоко, вследствие этого рассматривается как противопоказанный при лактации.
Подбор лечебных программ у беременных с СКВ зачастую представляет сложную задачу. Это обусловлено вариабельностью клинических проявлений и течения СКВ, а также необходимостью коррекции дозировок препаратов с учетом возрастающего объема циркулирующей плазмы, изменения лекарственной потребности вследствие возможной активации заболевания, опасности дисморфогенеза плода. Особенности лечебного режима определяются прежде всего наличием и степенью выраженности активности заболевания, висцеритов, артериальной гипертензии и почечной недостаточности, а также характером ведения больных до беременности и риском тератогенного и фетотоксического эффектов лекарственных препаратов.
В настоящее время нет единой точки зрения относительно необходимости применения патогенетической терапии в ходе беременности у больных СКВ, у которых при зачатии отмечалась ремиссия. Одни исследователи считают возможным ведение беременности в таких случаях без использования препаратов патогенетического воздействия (естественно, при отсутствии активации заболевания в ходе гестации), другие полагают необходимым проведение превентивной глюкокортикоидной терапии, аргументируя свое мнение снижением при этом частоты обострений СКВ в гестационном и пуэрперальном периодах. По мнению некоторых авторов, наличие даже неактивного ВГН требует обязательного применения глюкокортикоидов в ходе гестации с целью превентирования активации почечного поражения. Вместе с тем другие считают, что глюкокортикоиды в этих ситуациях малоэффективны.
Общепризнана необходимость проведения адекватной патогенетической терапии как до зачатия, так и в ходе гестации в случаях активной СКВ. При этом выбор терапии, дозировки препаратов и продолжительность их применения определяются степенью активности заболевания, его клиническими особенностями, а также возможностью и характером негативного лекарственного влияния на плод.
В ряде сообщений подчеркивается важность учета характера проводимого до зачатия лечения для выбора тактики ведения больной в период гестации. Так, M . Petri et al . (2006) полагают целесообразным продолжение приема больными глюкокортикоидов в ходе беременности с сохранением (при отсутствии обострения) дозировок, применявшихся до зачатия. По мнению M . E . B . Clowse et al . (2008), гестация не должна служить причиной отказа от применения азатиоприна, если больная принимала этот препарат до зачатия, а отмена его связана с реальной угрозой обострения СКВ.
Для больных с минимальной степенью активности СКВ ряд исследователей считает достаточно эффективными нестероидные противовоспалительные препараты или гидроксихлорохин. При более высокой активности СКВ у беременных обычно рекомендуется назначение глюкокортикоидов (табл. 4), причем дозировки препаратов не отличаются от таковых у небеременных с подобной степенью активности СКВ.

При тяжелых обострениях СКВ возможно применение сверхвысоких доз глюкокортикоидов (пульс-терапия), что позволяет эффективно купировать обострение и способствует успешному исходу беременности. Рядом специалистов, преимущественно в сообщениях, опубликованных в начале 90-х годов, высказывалось мнение о необходимости назначения (или увеличения дозы) преднизолона в интра- и постпартальном периодах с целью предотвращения возможных обострений СКВ. В этих работах рекомендовалось в период родоразрешения внутривенное применение гидрокортизона (200–300 мг/сут), а после родов или аборта — прием умеренных или высоких доз преднизолона в течение 6–8 недель с медленным снижением дозировки препарата до фоновых уровней. Следует отметить, что другие исследователи, отрицая эффективность применения ГК для профилактики обострений СКВ, не являются сторонниками подобной тактики.
При беременности у больных С KB некоторые исследователи считают возможным применение препаратов цитотоксического действия в случаях неэффективности глюкокортикоидной терапии для купирования обострений СКВ, а также при наличии противопоказаний к назначению высоких доз глюкокортикоидов или развитии тяжелых побочных эффектов глюкокортикоидной терапии. Из иммунодепрессантов цитотоксического действия допускают применение только азатиоприна с учетом высокого уровня его деградации в плаценте и относительно низкого риска развития аномалий у новорожденных. Подавляющее большинство авторов считает недопустимым назначение больным СКВ при беременности цитостатиков алкилирующего действия (циклофосфамид, хлорбутин) из-за потенциально высокого тератогенного действия, хотя описаны единичные случаи успешного исхода беременностей, в ходе которых женщины получали циклофосфамид. Применение азатиоприна у беременных с СКВ в большинстве случаев не сопровождается развитием серьезных соматических и хромосомных аномалий у новорожденных, однако при этом у них нередко развиваются лимфопения и умеренное снижение синтеза иммуноглобулинов, имеющие преходящий характер. В ряде ситуаций, когда контроля высокой активности волчаночного процесса не удается достичь применением высоких доз (включая пульс-терапию) глюкокортикоидов и азатиоприна, для купирования жизнеопасных обострений СКВ может быть использован циклоспорин.
При тяжелом прогрессирующем ухудшении функции почек у беременных с ВГН, приводящем к развитию выраженной почечной недостаточности, возможно проведение программного гемодиализа, что позволяет добиться успешного исхода беременности. Проведение диализных процедур больным ВГН при беременности осуществляется с учетом тех же требований, что и беременным с почечной недостаточностью, обусловленной первичным хроническим гломерулонефритом.
Повсеместное внедрение в клиническую практику программного гемодиализа и трансплантации почек привело к переосмыслению некоторых вопросов, связанных с беременностью у больных ВГН с хронической почечной недостаточностью. Применение методов замещения функции почек может приводить к восстановлению нарушенной при уремии способности к оплодотворению. Беременность, наступающая на фоне лечения программным гемодиализом, редко протекает успешно и во многих случаях сопровождается ухудшением состояния матери. Более благоприятным является прогноз как для плода, так и для матери в случаях, когда необходимость в применении гемодиализа впервые возникает во время беременности. В регистрах Европейской почечной ассоциации, Европейской ассоциации диализа и трансплантации, а также в Почечном регистре США представлены данные о беременностях у женщин с СКВ, перенесших трансплантацию почки. Показано, что течение гестации у таких женщин ассоциировано с увеличением частоты акушерских и неонатальных осложнений (в том числе внутриутробного инфицирования плода цитомегаловирусом), повышением риска активации СКВ, развития у матери гипертензионного синдрома, а также — в части случаев — с ухудшением функционирования почечного трансплантата. В то же время при устойчивом функционировании трансплантата до гестации, отсутствии признаков активности волчанки, артериальной гипертензии, а также при наличии тщательного контроля за состоянием матери и плода частота успешного исхода беременности (констатировавшегося при рождении живого плода без врожденных дефектов при отсутствии ухудшения функции трансплантата и других осложнений у матери) достигала 58–72 %.
Ведение АФЛ-позитивных женщин и женщин с антифосфолипидным синдромом при беременности
Серьезный фетальный и материнский прогноз требует обязательного тестирования на антифосфолипидные антитела всех больных СКВ в ранние сроки беременности, а в случаях выявления АФЛ показаны обязательное тщательное мониторирование их титров, состояния плода и незамедлительная индукция родов при появлении признаков фетального дистресса. Необходимым полагают обследование всех новорожденных от матерей с АФЛ на наличие этих антител в сыворотке крови с целью выбора адекватной тактики ведения в неонатальном периоде.
Профилактика возникновения венозных и артериальных тромбозов и превентирование внутриутробной гибели плода требуются у беременных с АФС при наличии в анамнезе данных о тромботических эпизодах и о самопроизвольных абортах. С этой целью могут быть использованы изолированно или в сочетании низкие или умеренные дозы аспирина (80–160 мг/сут) и нефракционированный гепарин для подкожного введения (чаще используются дозировки от 10 000 до 15 000 Е д /сут). С середины 90-х годов с профилактической целью у беременных с АФС нашли применение гепарины с низкой молекулярной массой (приоритет имеет эноксапарин). Показано, что при их использовании в ходе гестации значительно реже по сравнению с нефракционированным гепарином развиваются тромбоцитопения и остеопороз. Превентивная антитромботическая терапия при АФС в части случаев проводится и в послеродовом периоде (в сроки до 6–8 недель после родоразрешения). В связи с увеличением риска развития остеопороза при применении гепаринов у беременных в течение всего периода их использования рекомендуется прием добавок карбоната кальция и препаратов витамина D .
По мнению W . Lubbe (2004), W . Lubbe, G . Liggins (2005), наличие в циркуляции АФЛ у беременных с СКВ, особенно в случае имевшихся ранее самопроизвольных прерываниях гестации, является показанием для назначения высоких доз преднизолона (40–60 мг/сут) в сочетании с аспирином. Некоторые исследователи указывают на целесообразность использования у беременных с АФЛ азатиоприна. В то же время в последние годы использование преднизолона и азатиоприна резервируется у беременных с АФЛ при наличии симптоматики АФС. При катастрофическом АФС у беременных имеются сообщения об улучшении материнского и плодового прогноза при применении плазмафереза, пульс-терапии глюкокортикоидами и внутривенной терапии иммуноглобулином G .
Контрацепция у больных СКВ
С учетом риска развития обострений заболевания во время беременности или после родоразрешения (прерывания гестации) женщинам с СКВ настойчиво рекомендуется избегать незапланированных беременностей, в связи с чем вопросы контрацепции должны обсуждаться с каждой больной СКВ. Позиции ведущих клиницистов по вопросам контрацепции при СКВ претерпели определенные изменения за последние несколько лет. В сообщениях, опубликованных в 80-е годы, были представлены доказательства наличия связи приема эстрогенсодержащих комбинированных контрацептивов (при суточных дозировках около 50 мкг этинилэстрадиола) с обострениями СКВ. Например, в сообщении Jungers частота развития обострений СКВ и/или ВГН у женщин, получавших такие препараты, оказалась существенно выше, чем у не получавших, составив соответственно 43 % против 27 %. С учетом этих и подобных им данных для контрацепции у больных СКВ рекомендовались либо препараты, содержащие изолированно гестагены, либо альтернативные (барьерные) методы.
В последующем было отмечено, что использование более низких дозировок этинилэстрадиола (20–30 мкг/сут) при строгом отборе пациенток (молодые, при отсутствии признаков активности заболевания) может оказаться достаточно безопасным контрацептивным подходом. В сообщениях Julkinen et al ., Buyon et al . не было отмечено увеличения риска обострений СКВ при использовании такого режима контрацепции. В настоящее время ожидаются результаты контролируемого исследования SELENA ( Safety of Estrogens Lupus Erythematosus National Assessmett ), оценивавшего безопасность эстрогенсодержащих препаратов при СКВ; его результаты позволят уточнить вопросы тактики применения этих средств у обсуждаемой категории пациенток. До получения результатов этого исследования M . E . B . Clowse et al . (2008) полагают возможным выделить следующие подходы к контрацепции:
— применения оральных контрацептивов, содержащих эстрогены, следует, бесспорно, избегать у женщин с наличием в циркуляции антифосфолипидных антител, а также других факторов риска тромбоэмболических осложнений;
— оральные контрацептивы, содержащие низкие дозы синтетических эстрогенов, не являются противопоказанными женщинам с СКВ молодого возраста (≤ 35 лет) при отсутствии признаков активности заболевания и стабильном его течении, некурящим, не имеющим артериальной гипертензии, антифосфолипидных антител в циркуляции, а также других факторов риска тромбоэмболических осложнений. При приеме этих препаратов необходим тщательный контроль активности заболевания и симптоматики тромботических нарушений;
— у пациенток, которым противопоказано применение эстрогенсодержащих контрацептивов, возможно использование препаратов, содержащих изолированно гестагены (с учетом риска развития на фоне их приема таких осложнений, как нарушения менструального цикла, аменорея, кожные изменения, отеки, увеличение массы тела);
— механические барьерные методы, как эффективные и безопасные, целесообразно использовать при наличии противопоказаний к перечисленным выше контрацептивным подходам;
— внутриматочные контрацептивные средства не могут быть рекомендованы женщинам с СКВ вследствие особенно высокого риска развития инфекционных осложнений.
