Газета «Новости медицины и фармации» Кардиология (327) 2010 (тематический номер)
Вернуться к номеру
Роль визуализации в современной клинической практике: разбор клинических случаев
Авторы: Robert Safford, Клиника Мэйо, Флорида (США)
Версия для печати
На ежегодной научно-практической конференции Всеукраинской общественной организации «Ассоциация специалистов по эхокардиографии», которая состоялась 19 мая 2010 г . в Национальной медицинской академии последипломного образования им. П.Л. Шупика (Киев), мастер-класс провел профессор Роберт Саффорд, ведущий консультант кардиоваскулярного отделения Клиники Мейо (Джексонвилль, Флорида, США). В рамках мастер-класса был представлен ряд интересных дифференциально-диагностических случаев из личной клинической практики, которые публикуются ниже с его согласия.
Клинический случай 1
Афроамериканка 60 лет с сахарным диабетом 2-го типа в анамнезе обратилась в клинику с жалобами на одышку и отечность нижних конечностей при сопутствующей артериальной гипертензии (АГ). Во время объективного осмотра были выявлены типичные симптомы застойной сердечной недостаточности (СН): набухание шейных вен, ослабленное дыхание симметрично в нижних отделах легких, отечность нижних конечностей. Аускультация сердца патогномоничных феноменов не выявила. При проведении ЭхоКГ установлены нормальные размеры полостей сердца с умеренным снижением глобальной сократимости левого желудочка (ЛЖ) (фракция выброса 45 %), концентрическая гипертрофия ЛЖ и небольшой гидроперикард. ЭКГ была выполнена до обращения в клинику по поводу дообследования вследствие АГ (рис. 1).
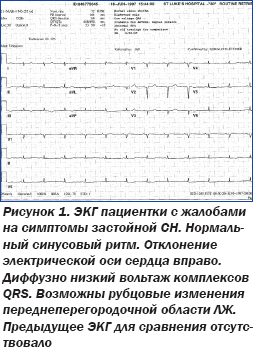
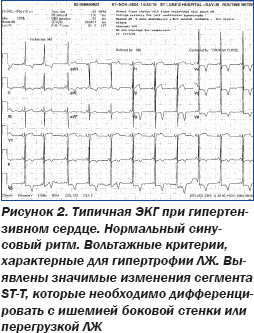
С учетом низкого вольтажа ЭКГ во всех отведениях, что является нетипичным для гипертензивного сердца, данный диагноз был поставлен под сомнение, поскольку для гипертензивного сердца характерна графика ЭКГ с высоким вольтажом комплексов QRS и развитием характерной графики гипертрофии и перегрузки ЛЖ (рис. 2).
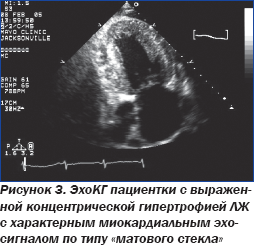
При оценке ЭхоКГ (рис. 3) возникает вопрос: вызваны ли описанные выше изменения наличием у больной АГ?
Соответственно, встает вопрос о следующем лечебно-диагностическом шаге с целью установления диагноза и проведения дальнейших лечебных мероприятий. Аудитории предлагается выбрать следующие лечебно-диагностические опции:
а) коронароангиография;
б) назначение ингибитора АПФ;
в) аспирация подкожного жира для биопсии;
г) перикардиоцентез;
д) назначение ибупрофена.
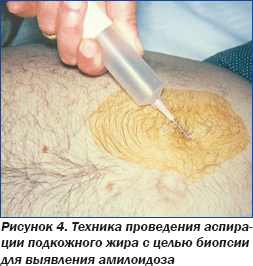
Сочетание низковольтажной ЭКГ с отсутствием патогномонически измененной графики и данных ЭхоКГ у пациентки негроидной расы привело к выводу о потенциальном амилоидозе сердца, вследствие чего была назначена аспирация подкожного жира с целью биопсии (рис. 4), которая подтвердила амилоидоз сердца (рис. 5).
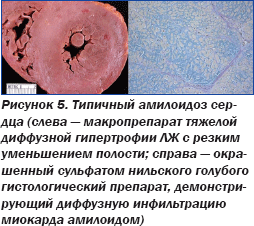
Профессор Р. Саффорд подчеркнул, что утолщение стенок ЛЖ по данным ЭхоКГ не всегда означает его гипертрофию. Если вольтаж QRS на ЭКГ неадекватно низкий, следует подозревать амилоидоз сердца, а не гипертензивное сердце или гипертрофическую кардиомиопатию. При этом повышенные уровни мозгового натрий-уретического пептида (BNP), который с егодня широко используется для диагностики СН, а также тропонина плазмы крови — предикторы неблагоприятного прогноза у пациентов с рестриктивной кардиомиопатией вследствие амилоидоза.
Клинический случай 2
Субъективно здоровая 34-летняя женщина арабского (сирийского) происхождения обратилась за медицинской помощью вследствие неспособности к зачатию. Во время лапароскопии в рамках мероприятий по лечению бесплодия был выявлен асцит. Пациентка была направлена на консультацию гастроэнтеролога. В том числе была выполнена обзорная рентгенография органов грудной клетки (ОРГК) в прямой и боковой проекциях, выявившая выраженное уплотнение перикарда в результате кальциноза (рис. 6). Таким образом, был установлен диагноз констриктивного перикардита, в результате чего пациентке была выполнена хирургическая перикардэктомия, в ходе которой был иссечен резко утолщенный перикард (рис. 7).
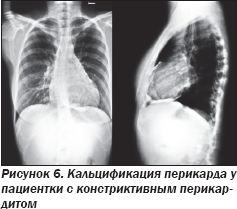

Биопсия выявила наличие неспецифического бактериального воспаления в полости перикарда, исключающего туберкулезную этиологию. Тем не менее следует подчеркнуть, что хотя наиболее частая этиология констриктивного перикардита во всем мире — туберкулез, который также может вызывать воспалительную окклюзию фаллопиевых труб и яичников, приводящую к бесплодию, в США констриктивный перикардит в подавляющем большинстве случаев является следствием кардиохирургических вмешательств в анамнезе. При этом диагноз является довольно несложным, поскольку обызвествление перикарда на ОРГК практически всегда означает перикардиальную констрикцию. ЭхоКГ обычно помогает дифференцировать перикардиальную констрикцию и рестриктивное поражение миокарда.
ЭхоКГ-признаками констрикции являются изменения (рис. 8, 9), происходящие вследствие разницы мгновенного давления в желудочках в разные фазы дыхания (рис. 10):
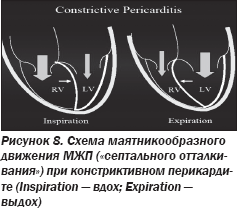
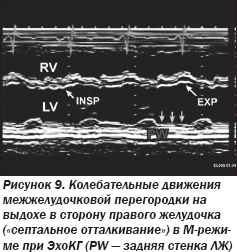
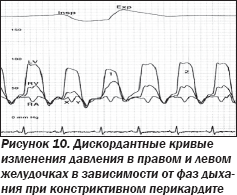
— «септальное отталкивание» в виде маятникообразного движения межжелудочковой перегородки (МЖП);
— ¯ трансмитральной скорости E (> 25 %) на вдохе;
— трикуспидальной скорости E (> 25 %) на вдохе;
— реверсия кровотока в печеночных венах в конце выдоха;
— застойная НПВ.
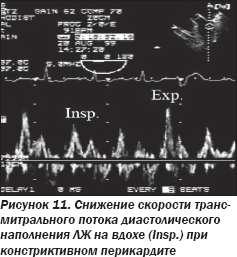
Кроме того, допплеровское исследование при констриктивном перикардите дает возможность отследить специфические изменения центральной гемодинамики, позволяющие провести дифференциальную диагностику:
— дыхательные вариации митрального (рис. 11), трикуспидального и кровотока в печеночных венах, аналогичные таковым при тампонаде сердца (следует помнить, что в ряде случаев у пациентов с констриктивным перикардитом может не наблюдаться характерных дыхательных колебаний, а оценку следует проводить повторно после снижения преднагрузки);
— нормальная скорость ранне-диастолического движения миокарда по данным тканевого допплера митрального кольца.
Клинический случай 3
Мужчина 29 лет, который до момента возникновения жалоб считал себя здоровым, поступил в клинику с жалобами на выраженную боль в груди через неделю от возникновения жалоб. Хотя пациент отрицал шумы в сердце в анамнезе, при аускультации был выявлен шум аортальной недостаточности (АН). Ниже представлена его фотография (рис. 12, 13).

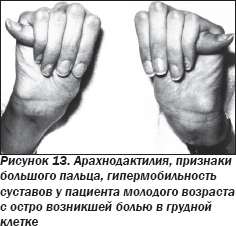
Наличие следующих типичных фенотипических признаков дисплазии соединительной ткани позволило установить диагноз синдрома Марфана:
— резко выраженная астеническая конституция;
— повышенная растяжимость кожи (более 3 см над наружными концами ключиц);
— воронкообразная деформация грудной клетки;
— сколиоз;
— плоскостопие (продольное и поперечное);
— миопия;
— гипермобильность суставов (3 и более);
— варикозное расширение вен (в том числе варикоцеле у мужчин);
— положительные признаки большого пальца (возможность вывести дистальную фалангу большого пальца за ульнарный край ладони) (рис. 13) и запястья (первый и пятый пальцы перекрещиваются при обхвате запястья противоположной руки).
Сочетание впервые возникшей АН и острой боли в грудной клетке предполагает подозрение на расслоение аорты. В частности, habitus данного пациента типичен для синдрома Марфана: высокий рост, удлиненные конечности, дистопия хрусталиков, дистопия коленных чашек, деформация грудной клетки, гипермобильность суставов, плоскостопие.
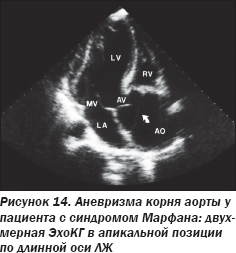
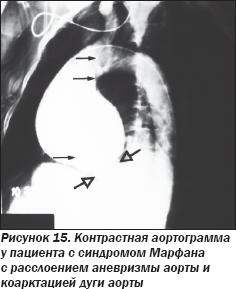
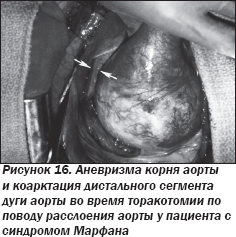
ЭхоКГ и контрастная ангиография аорты (рис. 14, 15) подтвердили наличие аневризмы корня аорты и восходящей аорты в сочетании с коарктацией аорты в дистальном отделе дуги аорты, что также подтвердилось во время оперативного вмешательства (рис. 16).
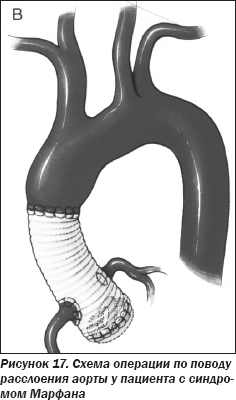
Пациенту было успешно проведено протезирование восходящей аорты ксенопротезом, имплантация механического протеза аортального клапана с реимплантацией устий коронарных артерий в ксенопротез восходящей аорты (рис. 17).
Кроме того, следует подробнее остановиться на описании марфаноподобного синдрома Loeys — Dietz. Это недавно открытый генетический синдром, наследуемый по аутосомно-доминантному признаку с марфаноподобным фенотипом, вызванным мутацией бета-рецепторов 1 или 2 к трансформирующему фактору роста (TGFBR-1 или 2). Для данного синдрома в отличие от классического синдрома Марфана характерны следующие признаки:
— широко поставленные глаза (гипертелоризм);
— расщепление язычка;
— склонность к формированию гематом и рубцов при незначительных травмах;
— разрыв/расслоение аорты при меньших ее диаметрах по сравнению с синдромом Марфана.
Сейчас Национальным институтом здоровья США проводится большое многоцентровое клиническое исследование по изучению эффектов лозартана при данной патологии.
Клинический случай 4
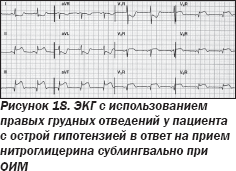
Мужчина 65 лет поступил в ургентном порядке в отделение реанимации и интенсивной терапии с жалобами на тошноту и чувство сдавления в груди. Диагностирован нижнебазальный острый инфаркт миокарда (ОИМ). Объективно: ЧСС — 50 уд/мин, АД — 106/60 мм рт.ст., аускультация легких и сердца — без особенностей. Врачом с целью снижения дискомфорта в грудной клетке назначен нитроглицерин в стандартной дозировке сублингвально, что вызвало острую гипотензию со снижением систолического АД до 60 мм рт.ст. В положении лежа одышка, шумы в сердце не фиксировались. Принимая во внимание негативные эффекты дачи нитроглицерина, была выполнена повторная ЭКГ с учетом правых грудных отведений (рис. 18, 19), что позволило установить ОИМ правого желудочка (ПЖ).
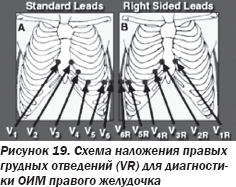
Было подчеркнуто, что поскольку ОИМ правого желудочка является весьма редкой патологией, следует помнить, что для дифференциальной диагностики большое значение имеет развитие острой гипотензии в ответ на назначение периферических вазодилататоров, в частности нитратов, при задних локализациях ОИМ ( Ferguson // Am . J . Cardiol . — 1989. — 64. — 311), так как наличие элевации ST в правых грудных отведениях является предиктором неблагоприятного прогноза при нижнебазальном ОИМ ( Zehander // NEJM . — 1993. — 328. — 981). Так, в исследовании Ferguson в 38 случаях ОИМ правого желудочка из 25 случаев острой гипотензии (89 %) в 20 случаях гипотензия развивалась именно после назначения нитратов, в то время как спонтанная гипотензия наблюдалась лишь в 5 случаях. Поэтому следует помнить основные признаки особых клинических состояний при острых коронарных синдромах с учетом специфических нарушений гемодинамики:
— кардиогенный шок — гипотензия, олигурия, нарушение сознания, отек легких;
— ОИМ правого желудочка — гипотензия ± застойные яремные вены, без отека легких, нитрат- и объем-зависимость клиники;
— разрыв миокарда — гипотензия, ажитация вследствие проведения вагусных проб, застойные яремные вены, громкие сердечные тоны (без аускультации), высокая смертность;
— разрыв межжелудочковой перегородки — гипотензия, пальпаторное дрожание, грубый систолический шум, с острой левожелудочковой недостаточностью или без таковой;
— разрыв митрального клапана с острой митральной недостаточностью — острый тяжелый отек легких, короткий грубый систолический шум на верхушке.
Следует также помнить, что пациенты с ОИМ правого желудочка нуждаются в высоком давлении наполнения ЛЖ для поддержания сердечного выброса, поэтому использование препаратов, снижающих преднагрузку за счет венозной дилатации (нитраты) или снижения ОЦК (диуретики), у таких пациентов обычно ведет к тяжелой гипотензии.
Клинический случай 5
Мужчина 80 лет поступил в отделение реанимации и интенсивной терапии с клиникой острого нарушения мозгового кровообращения (ОНМК), развившегося 3 дня назад. В анамнезе: ишемическая болезнь сердца, синдром слабости синусового узла (синдром тахи-бради), артериальная гипертензия, сахарный диабет 2-го типа. Четыре месяца тому назад по поводу синкопальных состояний вследствие синдрома слабости синусового узла был установлен одноэлектродный искусственный водитель ритма (ИВР). Коагуляционный статус: INR 1.8. Лечащий невролог назначил проведение общих лабораторных исследований, ЭКГ, ОРГК, чреспищеводную эхокардиографию и компьютерную томографию головного мозга. Также неврологом были высказаны сомнения относительно целесообразности тромболитической терапии. Ниже приведена ЭКГ пациента (рис. 20).
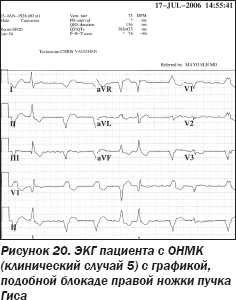
При локализации электрода однокамерного ИВР в правом желудочке графика комплексов QRS ЭКГ должна напоминать графику блокады левой ножки пучка Гиса (рис. 21).
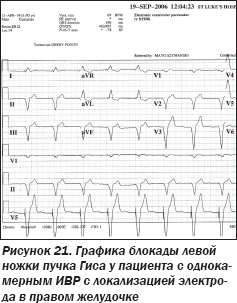
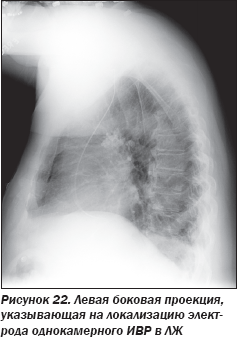
Графика ЭКГ, напоминающая блокаду правой ножки пучка Гиса, у пациента с однокамерным ИВР, предполагающим локализацию электрода в ПЖ, заставила консилиум усомниться в локализации электрода в ПЖ, поскольку графика блокады правой ножки пучка Гиса предполагает нахождение электрода в ЛЖ. Поэтому была выполнена ОРГК в левой боковой проекции (рис. 22), позволившая усомниться в локализации электрода в правом желудочке. Была выполнена чреспищеводная ЭхоКГ, явно продемонстрировавшая локализацию электрода ИВР в ЛЖ. При этом электрод ИВР проходил в ЛЖ из аорты через аортальный клапан (рис. 23).
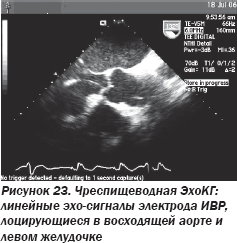
Таким образом, ОНМК развилось по причине тромбоэмболии тромбом на электроде ИВР, ошибочно установленном в левые отделы сердца вследствие пункции подключичной артерии, а не вены. Данную ятрогенную ситуацию можно назвать «рассказом о множестве упущенных возможностей», поскольку в ходе телефонного контакта с медицинским центром, где выполнялась установка ИВР, хирург отметил, что в ходе процедуры имело место необычно повышенное «венозное» давление (120 мм рт.ст.), но подтвердил наличие электрода в правых отделах. Таким образом, из данной клинической ситуации были сделаны определенные выводы.
После установки постоянного ИВР всегда следует наблюдать динамику ЭКГ для уверенности в том, что морфология пейсмейкерных сокращений соответствует требуемому положению желудочкового
(-ых) электрода(-ов), а также для того, чтобы подтвердить положение электрода(-ов) по данным ОРГК, особенно в боковой проекции.
Но главное, традиционные технологии все еще занимают важное место в медицинской практике, и использование дорогостоящих методик визуализации не заменяет врачу клинического мышления.
Перевод С.В. ПОТАШЕВА,
ассистента кафедры кардиологии и функциональной диагностики НМАПО им. П.Л. Шупика
