Газета «Новости медицины и фармации» Неврология (328) 2010 (тематический номер)
Вернуться к номеру
Каротидная эндартерэктомия и каротидное стентирование: взгляд невролога
Авторы: С.С. Кучеренко, Национальный медико-хирургический центр имени Н.И. Пирогова, г. Москва, Россия
Версия для печати
Хирургическая реваскуляризация давно и широко используется при атеросклеротическом поражении различных сосудистых бассейнов [1]. Из хирургических методов применяются операции транслюминальной баллонной ангиопластики со стентированием (ТБАС) и каротидной эндартерэктомией (КЭЭ). Указанные инвазивные методы лечения становятся рутинной клинической практикой. Вместе с тем достаточно актуальной остается проблема выбора вида вмешательства при проведении таких операций. Корректный отбор пациентов является одним из важнейших залогов успешности инвазивной манипуляции. Поэтому следует чрезвычайно жестко подходить к оценке показаний для тех или иных вмешательств. Последние неоднократно уточнялись, а дебаты, касающиеся их валидности, продолжаются до сих пор. Наиболее часто выполняется КЭЭ — хирургическое вмешательство, направленное на удаление атеросклеротической бляшки из сонной артерии, позволяющее устранить гемодинамически значимый стеноз и предотвратить артериоартериальную эмболию [1]. В соответствии с рекомендациями по ведению больных с ишемическим инсультом и транзиторными ишемическими атаками исполнительного комитета Европейской инсультной организации, операция КЭЭ рекомендована пациентам со стенозами сонных артерий 70–99 % и должна выполняться в центрах с показателем периоперационных осложнений (любой инсульт и смерть) менее 6 % [10]. Основные периоперационные неврологическе осложнения КЭЭ — цереброваскулярные расстройства, причинами которых являются эмболия, гипоперфузия и гиперперфузия.
В последнее время прогрессивно развивающиеся методы интервенционной хирургии способствовали внедрению методики ангиопластики и стентирования сонных артерий (ССА). Стентированием называется установка в суженную часть артерии стента, который представляет собой металлическую трубочку, состоящую из ячеек. Раскрываясь, стент изнутри раздвигает суженные стенки артерии и постоянно поддерживает их в расправленном состоянии. Благодаря этому восстанавливается внутренний просвет артерии и тем самым улучшается кровоснабжение головного мозга. К преимуществам такого вмешательства относятся: возможность выполнения его чрескожным доступом под местной анестезией, проведение операции больным после ранее перенесенной КЭЭ, возможность одномоментной реваскуляризации различных сосудистых бассейнов, минимальная продолжительность ишемии мозга при баллонной дилатации, отсутствие местных хирургических осложнений, сокращение времени пребывания в стационаре. Вместе с тем метод ТБАС имеет ряд специфических осложнений: диссекцию сосудов, преходящий вазоспазм, гипотензию и брадикардию, нефропатию вследствие использования контрастного вещества, а также микроэмболизацию церебральных артерий.
С целью интраоперационного контроля церебральной гемодинамики при описанных вмешательствах используется транскраниальная допплерография, которая позволяет диагностировать в реальном времени все три основные причины осложнений: эмболию, гипоперфузию и гиперперфузию [8, 12].
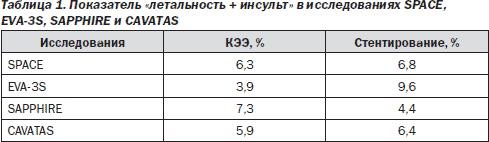
В настоящее время продолжается сравнительное изучение КЭЭ и ТБАС. В 2007 году опубликованы результаты двух крупных мультицентровых рандомизированных исследований SPACE и EVA-3S. В исследовании SPACE (Stent-protected Angioplasty versus Carotid Endarterectomy in symptomatic patients) приняло участие 1200 пациентов и было выявлено, что частота таких осложнений, как ипсилатеральный инсульт или смерть до 30-го дня, в группе ССА составила 6,8 %, в группе КЭЭ — 6,3 % [9]. Во французском исследовании EVA-3S (Endarterectomy versus Stenting in Patients with Symptomatic Severe Carotid Stenosis) приняло участие 527 пациентов и было определено, что совокупный показатель «летальность + инсульт» после КЭЭ составил 3,9 %, после стентирования — 9,6 %. Исследование было прекращено досрочно по соображениям безопасности [7].
Не меньший интерес представляют данные американских проспективных рандомизированных исследований: SAPPHIRE (Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy) и CAVATAS (Carotid and Vertebral Artery Transluminal Angioplasty Study). В первое исследование было включено 307 пациентов из 29 клиник США, во второе — 504 пациента. В исследовании SAPPHIRE совокупный показатель «летальность + инсульт» составил 7,3 % после КЭЭ и 4,4 % — после стентирования. Так как в это исследование было включено более 70 % больных с асимптомными стенозами, эти данные следует рассматривать в рамках первичной профилактики [13]. В исследовании CAVATAS совокупный показатель «летальность + инсульт» составил 5,9 % после КЭЭ и 6,4 % — после стентирования. Правда в этом исследовании большинству больных в группе эндоваскулярного лечения выполнялась ангиопластика, стентирование проводилось только в 26 % случаев [5]. Процент осложнений тех или иных вмешательств по результатам 4 упомянутых выше исследований представлен в табл. 1.
Проведенный анализ результатов мультицентровых плацебо-контролируемых исследований, а также многочисленных публикаций отечественных и зарубежных исследователей позволяет заключить, что на сегодняшний день отсутствуют однозначно трактуемые показания и противопоказания к КЭЭ и стентированию.
До настоящего времени выбор метода реваскуляризации базируется на эмпирических представлениях [1]. Целью настоящего исследования явилось сравнение эффективности и безопасности этих двух видов хирургических вмешательств.
Материалы и методы
Обследовано 134 пациента (102 мужчины и 32 женщины) в возрасте 48–77 лет с давностью инсульта от 8 до 47 дней, с симптомным стенозом ипсилатеральной внутренней сонной артерии 70 % и более. Диагноз устанавливался при дуплексном сканировании и дигитальной субтракционной ангиографии экстра- и интракраниальных церебральных артерий. Больным первой группы (95 пациентов) выполнялась КЭЭ, второй группы (39 пациентов) — транслюминальная баллонная ангиопластика со стентированием с использованием систем дистальной защиты. Распределение больных в группы имело случайный характер. Обе группы были сопоставимы по полу, возрасту, исходным клиническим данным, фоновым заболеваниям, степени стеноза внутренней сонной артерии. Всем больным выполнялись интраоперационный мониторинг скоростных показателей мозгового кровотока и регистрация микроэмболических сигналов (МЭС). Проанализирована выраженность неврологического дефицита по шкале NIHSS, индексу Бартел, степени инвалидизации по Ранкину на 2-е сутки, через 1 месяц и 1 год после хирургического вмешательства.
Результаты исследования
В ближайшем послеоперационном периоде в обеих группах больных признаков нарастания очагового неврологического дефицита выявлено не было. В 1-й группе в раннем послеоперационном периоде зарегистрировано 5 случаев сосудистой смерти (5,3 %). Также в 3 наблюдениях (3,2 %) выявлена травматическая нейропатия подъязычного нерва, связанная, вероятно, с его сдавлением при выделении ВСА. Во 2-й группе повторные ишемические атаки не развились, случаев смерти не было. Отсутствовали статистически значимые различия параметров NIHSS, индекса Бартел, степени инвалидизации по Ранкину у больных обеих групп на 2-е сутки и через 1 месяц после вмешательства. Через 1 год после хирургического вмешательства значимых различий параметров NIHSS также не было выявлено в обеих группах. Не обнаружено статистически значимого улучшения жизнедеятельности у пациентов 1-й группы по сравнению с пациентами 2-й группы. По данным интраоперационного допплеровского мониторинга не обнаружено статистически значимого различия прироста линейной скорости кровотока после проведенной операции у пациентов 1-й группы по сравнению со 2-й. Количество выявленных МЭС было значимо большим во 2-й группе по сравнению с 1-й группой.
Выводы
Периоперационная, а также отдаленная оценка результатов КЭЭ и ТБАС не показала статистически достоверных преимуществ одного из указанных методов. КЭЭ и ТБАС имеют одинаковую эффективность и безопасность. Различия в количестве интраоперационных МЭС могут быть обусловлены появлением «клинически незначимых» воздушных микроэмболов. Для решения вопроса о выборе метода хирургического вмешательства с целью реваскуляризации головного мозга необходим индивидуальный подход в каждой конкретной клинической ситуации.
1. Кузнецов А.Н. Современные принципы лечения мультифокального атеросклероза // Вестник Национального медико-хирургического центра имени Н.И. Пирогова. — 2008. — Т. 3, № 1. — С. 78-83.
2. Albers G.W., Caplan L.R.,
3. Algra A., Gates P.C., Fox A.J. et al. North American Symptomatic Carotid Endarterectomy Trial (NASCET) Group. Side of brain infarction and long-term risk of sudden death in patients with symptomatic carotid disease // Stroke. — 2003. — Vol. 34, № 12. — P. 2871-2875.
4. Arenillas J.F., Molina
5. Brown M.M., Rogers J., Bland J.M. Endovascular versus surgical treatment in patients with carotid stenosis in the carotid and vertebral artery transluminal angioplasty study (Cavatas): a randomised trial // Lancet. — 2001. — Vol. 357, № 2. — P. 1729-1737.
6. Gorelick P.B. Stroke prevention therapy beyond antithrombotics: unifying mechanisms in ischemic stroke pathogenesis and implications for therapy: an invited review // Stroke. — 2002. — Vol. 33, № 3. — P. 862-875.
7. Mas J.L., Chatellier G., Beyssen B. et al. Endarterectomy versus stenting in patients with symptomatic severe carotid stenosis // New England Journal of Medicine. — 2006. — Vol. 355, № 16. — P. 1660-1671.
8. Muller M., Behnke S., Walter P. et al. Microembolic signals and intraoperative stroke in carotid endarterectomy //Acta Neurol. Scand. — 1998. — Vol. 97. — P. 110-117.
9. Ringleb P.A., Allenberg J.R., Berger J. et al. 30 day results from the space trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial // Lancet. — 2006. — Vol. 368, № 7. — P. 1239-1247.
10. Ringleb P.A., Bousser M.-G., Ford G. et al. ESO-Guidelines for Management of Ischaemic Stroke. — 2008. — P. 120.
11. Sacco R.L., Adams R., Albers G. et al. Guidelines for prevention of stroke in patients with ischemic stroke of transient ischemic attack // Stroke. — 2006. — Vol. 37, № 2. — P. 577-617.
12. Smith J.L., Evans D.H., Gaunt M.E., et al. Experience with transcranial Doppler monitoring reduces the incidence of paniculate embolization during carotid endarterectomy // Brit. J. Surg.— 1998. — Vol. 85, № 1. — P. 56-59.
13. Yadav J., Sholey M., Kuntz R. et al. Protected carotid-artery stenting versus endarterectomy in high-risk patients // New England Journal of Medicine. — 2004. — Vol. 351, № 15. — P. 1493-1501.
