Газета «Новости медицины и фармации» Дерматология (319) 2010 (тематический номер)
Вернуться к номеру
Вплив добових ритмів щитоподібної залози на ступінь окиснювальної модифікації білків у хворих на алергодерматози
Авторы: О.І. Денисенко, Буковинський державний медичний університет, м. Чернівці
Версия для печати
Вступ
Дослідження патогенетичних чинників алергодерматозів (АД) з метою вдосконалення їх лікування є одним з актуальних завдань сучасної дерматології [3, 4, 20]. Як засвідчують клінічні спостереження, алергічні захворювання шкіри в останні роки відзначаються поширеністю, тяжким клінічним перебігом та торпідністю до традиційних методів лікування, що призводить до тривалої непрацездатності пацієнтів, погіршення якості їх життя [6, 8, 15–17]. Незважаючи на численні дослідження, патогенез АД залишається остаточно не вивченим [3–5, 14, 18]. В останні роки увага дослідників привернута до з''ясування патогенетичної ролі в розвитку та перебігу АД окисно-відновних порушень [11]. Як встановлено, у формуванні стану ендогенної інтоксикації при патологічних станах разом із процесами пероксидації ліпідів беруть участь процеси окислювальної модифікації білків [12], у регуляції яких важливу роль відіграють ендокринні органи, зокрема гіпофізарно-тиреоїдна система [1, 10].
Водночас, за даними досліджень з хронобіології, ранні ознаки розвитку патологічних станів, у тому числі й ендокринних органів, можна виявити за змінами їх ритмологічної функції, зокрема за параметрами добових ритмів їх показників [13, 19]. Також існують повідомлення [2], які засвідчують, що методи лікування є більш ефективними у разі їх хронобіологічної детермінованості з урахуванням добових ритмів показників гомеостазу, зокрема окисно-відновних процесів, на що слід зважати при розробці хронодетермінованих методів терапії захворювань людини, у тому числі хронічних дерматозів.
Мета роботи — встановити у хворих на алергодерматози особливості добових ритмів функції щитоподібної залози та їх вплив на показники окислювальної модифікації білків.
Матеріали та методи дослідження
Спостерігали 38 хворих на АД (екзема, алергічний дерматит, нейродерміт, атопічний дерматит), серед яких було 27 чоловіків та 11 жінок віком від 19 до 67 років. У 30 пацієнтів захворювання шкіри мало хронічний перебіг від 1 до 24 років, у решти 8 — діагностовано вперше. Групу контролю становили 24 практично здорові особи (донори).
Функціональний стан гіпофізарно-тиреоїдної системи оцінювали за рівнем у сироватці крові тиреотропного гормону (ТТГ), трийодтироніну (Т3) та тироксину (Т4), що визначали методом радіоімунного аналізу з використанням стандартних тест-наборів РІО-Т3-ІПР і РІО-Т4-ІПР виробництва Республіки Білорусь та РІА-ТТГ (Чехія).
Окислювальну модифікацію білків (ОМБ) у сироватці крові визначали методом І.Ф. Мещишена [9], який базується на тому, що в процесі окислювальної модифікації білків плазми (сироватки) крові в радикалах залишків аліфатичних амінокислот утворюються альдегідні й кетонні групи. Останні взаємодіють з 2,4-динітрофенілгідразином з утворенням 2,4-динітрофенілгідразонів, що мають характерний спектр поглинання. Альдегідо- і кетонопохідні нейтрального характеру реєстрували при 370 нм, а основного характеру — при 430 нм. Для визначення характеру добових ритмів досліджуваних показників забір крові проводили тричі впродовж доби — о 08.00, 16.00 та 24.00. Отримані дані обробляли методами косинор-аналізу та варіаційної статистики, використовуючи критерій Стьюдента (t), за вірогідну приймали різницю середніх при р < 0,05; вивчали динаміку мезорів (середнього рівня показника) у різні періоди доби.
Для визначення характеру зв''язків між показниками визначали коефіцієнт кореляції (R) методом кореляційного аналізу [7].
Результати та їх обговорення
При клінічному обстеженні хворих на АД встановлено, що у більшості (у 30–78,9 %) пацієнтів патологічний процес на шкірі мав поширений характер, у решти 8 (21,1 %) осіб — був обмеженим. Практично у всіх (у 35–92,1 %) пацієнтів було діагностовано гостру стадію АД з вираженими ознаками запалення шкіри.
Як показали результати досліджень (табл. 1), у хворих на АД порівняно з особами контрольної групи відзначено тенденцію (p > 0,05) до збільшення мезорів Т3 й ТТГ та зменшення мезорів Т4. Водночас відзначено тенденцію мезорів Т3 і Т4 до зменшення впродовж доби, а ТТГ — до збільшення.
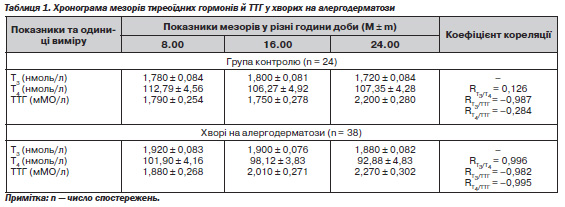
Як свідчать дані, наведені у табл. 1, у хворих на АД відзначається чітка залежність між показниками гіпофізарно-тиреоїдної системи: прямо пропорційний зв''язок між Т3 і Т4 (R = 0,996; у групі контролю R = 0,126) та протилежна залежність між Т3 і ТТГ (R = –0,982; у групі контролю R = –0,987), а також між Т4 і ТТГ (R = –0,995; у групі контролю R = –0,284).
Водночас у хворих на АД встановлено (табл. 2) вірогідне (p < 0,001) збільшення мезорів ОМБ, визначених як за альдегідо- й каталазопохідними нейтрального, так і альдегідо- та каталазопохідними основного характеру, з тенденцією до їх збільшення впродовж доби. Аналіз динаміки мезорів трийодтироніну та ОМБ у хворих на АД виявив порушення їх співвідношення — на відміну від прямо пропорційної їх залежності в осіб контрольної групи (R = 0,806 і 0,863) у хворих на АД реєструється їх зворотна залежність (R = –0,997 і –0,965).
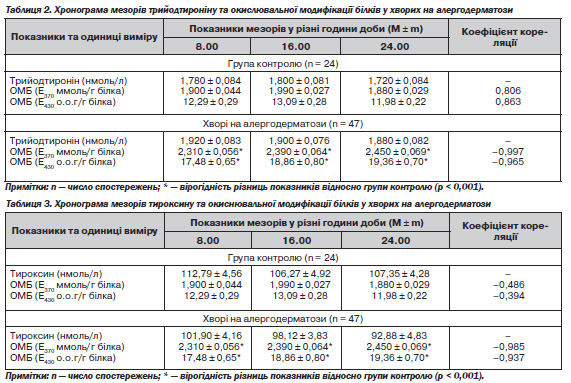
Аналогічна зворотна залежність у хворих на АД (табл. 3) встановлена й між динамікою впродовж доби мезорів тироксину та ОМБ (R = –0,985 і –0,937; в осіб контрольної групи відповідно: R = –0,486 і –0,394).
Отже, як видно з наведених у табл. 2 і 3 даних, збільшення у хворих на АД показників окислювальної модифікації білків, що свідчило про формування стану ендогенної інтоксикації й окислювального стресу, не супроводжувалося компенсаторною активацією тиреоїдних гормонів, зокрема тироксину, який має антиоксидантну дію.
Аналіз динаміки мезорів ТТГ й ОМБ у хворих на АД (табл. 4) виявив їх прямо пропорційну залежність (R = 0,963 і 0,897; у групі контролю: R = –0,700 і –0,769), що можна трактувати як компенсаторну активацію гіпофіза у відповідь на зменшення впродовж доби в сироватці крові рівня тиреоїдних гормонів, а також як можливу відповідь на наростання стану ендогенної інтоксикації в організмі пацієнтів під час загострення у них АД.
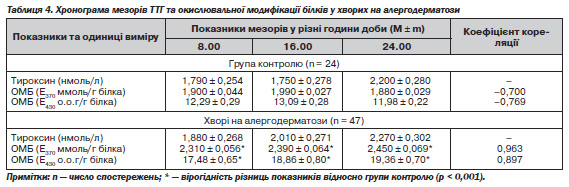
Таким чином, у хворих на АД виявлено зміни ритмологічної функції гіпофізарно-тиреоїдної системи, а також процесів окислювальної модифікації білків, між якими встановлено прямі чи зворотні зв''язки. Незважаючи на тенденцію в цілому до підвищення порівняно з показниками осіб контрольної групи рівня трийодтироніну, рівень тироксину у хворих на АД мав тенденцію до зменшення. Водночас аналіз співвідношення динаміки мезорів тиреоїдних гормонів та ступеня ОМБ також засвідчив функціональну недостатність щитоподібної залози в період загострення АД — рівень тиреоїдних гормонів упродовж доби зменшувався, а ступінь ОМБ, навпаки, зростав. Отже, аналіз показників мезорів тиреоїдних гормонів й ОМБ у хворих на АД, зокрема їх динаміки впродовж доби, виявив ознаки функціональної недостатності щитоподібної залози з формуванням у пацієнтів під час загострення алергічних дерматозів стану ендогенної інтоксикації. Наведені дані обгрунтовують доцільність призначення хворим на АД засобів антиоксидантної дії, причому з урахуванням особливостей динаміки їх добових ритмів.
Висновки
1. У хворих на алергодерматози встановлено тенденцію до збільшення мезорів Т3 й ТТГ та зменшення мезорів Т4, а також тенденцію до зменшення впродовж доби мезорів тиреоїдних гормонів та фоні збільшення ТТГ.
2. У хворих на алергічні дерматози встановлено вірогідне збільшення мезорів ОМБ із тенденцією до наростання ступеня окислювальної модифікації білків упродовж доби.
3. У період загострення алергічних дерматозів встановлено порушення прямого співвідношення між динамікою мезорів ОМБ і трийодтироніну (R = –0,997 і –0,965; у групі контролю — R = 0,806 і 0,863), а також наявність зворотного зв''язку між динамікою мезорів ОМБ й тироксину (R = –0,985 і –0,937; в осіб контрольної групи — R = –0,486 і –0,394) й появу прямої залежності між динамікою ОМБ й ТТГ (R = 0,963 і 0,897; у групі контролю — R = –0,700 і –0,769).
4. З огляду на встановлені у хворих на АД показники гіпофізарно-тиреоїдних гормонів і ОМБ та особливості їх добових ритмів доцільним є включення в комплексне лікування таких пацієнтів засобів антиоксидантної дії з їх хронодетермінованим призначенням (у другій половині дня).
Перспективи подальших досліджень
Встановлення у хворих на алергодерматози особливостей добових ритмів функції щитоподібної залози та їх впливу на ступінь окислювальної модифікації білків визначає перспективи оптимізації лікування алергічних захворювань шкіри на підставі розробки хронодетермінованих методів антиоксидантної терапії.
1. Благосклонная Я.В., Шляхто Е.В., Бабенко А.Ю. Эндокринология. — Санкт-Петербург: СпецЛит, 2004. — С. 126-187.
2. Загускин С.Л. Хронобиологическое направление лазерной медицины // Мат-лы междунар. конф. «Новые направления лазерной медицины». — М., 1996. — С. 296-297.
3. Іванов С.В. Зміни терморегуляції при деяких алергодерматозах // Укр. журнал дерматол., венерол., косметол. — 2005. — № 3 (18). — С. 141.
4. Іваночко Л.Й. Обмінні процеси у хворих на екзему // Укр. журнал дерматол., венерол., косметол. — 2005. — № 3 (18). — С. 141.
5. Качук М.В. Влияние повышенного содержания тиреоидных гормонов на усиление кожно-аллергического процесса // Акт. вопр. мед. и биол. — Днепропетровск, 1993. — Вып. IV. — С. 102.
6. Кравец Е.В. Опыт лечения больных аллергодерматозами, осложненными пиодермией // Журнал дерматовенерол. и косметол. им. Н.А. Торсуева. — 2004. — № 1–2(8). — С. 131-132.
7. Лапач С.Н., Чубенко А.В., Бабич П.Н. Статистические методы в медико-биологических исследованиях с использованием Excel. — К.: Морион, 2001. — 408 с.
8. Мавров И.И., Волкославская В.Н., Гутнев А.Л., Денисенко О.И. Влияние антропогенных загрязнителей на уровень заболеваемости аллергодерматозами в Восточном и Западном регионах Украины // Дерматол. та венерол. — 2003. — № 2 (20). — С. 3-6.
9. Мещишен І.Ф. Метод визначення окислювальної модифікації білків плазми (сироватки) крові // Бук. мед. вісник. — 1998. — Т. 2, № 1. — С. 156-158.
10. Мещишен І.Ф., Пішак В.П. Обмін речовин у людини. — Чернівці: Медінститут, 1995. — 193 с.
11. Паращук Б.М. Роль стану антиоксидантної функції організму в патогенезі розвитку екземи та псоріазу // Дерматовенерол., косметол., сексопатол. — 2001. — № 1(4). — С. 98-100.
12. Рябов Г.Я., Азизов Ю.М., Дорохов С.И. и др. Окислительная модификация белков плазмы крови у больных в критических состояниях // Анестезиол. и реаниматол. — 2000. — № 2. — С. 72-75.
13. Хронобиология и хрономедицина / Под ред. Ф.И. Комарова. — М.: Медицина, 1989. — 400 с.
14. Allam J.-P., Novak N. The pathophysioligy of atopic eczema // Clin. Experim. Dermatol. — 2006. — Vol. 31, № 1. — P. 89-93.
15. Baron S.E., Morris P.K., Dye L. et al. The effect of dermatology consultations in secondary care on treatment outcome and quality of life in new adult patients with atopic dermatitis // Brit. J. Dermatol. — 2006. — Vol. 154, № 5. — P. 942-949.
16. Holm E.A., Wulf H.C., Stegmann H., Jemec G.B.E. Life quality assessment among with atopic eczema // Brit. J. Dermatol. — 2006. — Vol. 154, № 4. — P. 719-725.
17. Loffler H., Steffes A., Happle R., Effendy I. Allergy and irritation: an adverse association in patients with atopic eczema // Acta Derm. Venereol. — 2003. — Vol. 83, № 5. — P. 328-331.
18. Möhrenschlager M., Darsow U., Schnopp C., Ring J. Atopic eczema: what''s new // J. Europ. Acad. Derm. Venereol. — 2006. — Vol. 20, № 5. — P. 503-513.
19. Orefice R., Nissini M., Giorola G. Circadian rhythm of thyrotropin is preserved in early pregnancy // J. Clin. Endocr. — 1990. — Vol. 52, № 1. — P. 75.
20. Pua V.S.C., Barnetson R.St.C. Recent developments in the treatment of adult atopic dermatitis // Austral. J. Dermatol. — 2006. — Vol. 47, № 2. — P. 84-89.
