Газета «Новости медицины и фармации» 5(311) 2010
Вернуться к номеру
Клінічний досвід застосування Сульбактомаксу при пієлонефриті в дітей
Авторы: Д.Д. Іванов, С.В. Кушніренко. Національна медична академія післядипломної освіти ім. П.Л. Шупика, кафедра нефрології, міський дитячий нефрологічний центр при МКДЛ № 1
Версия для печати
Незважаючи на наявні успіхи у діагностиці та лікуванні різних клінічних форм інфекцій сечовивідних шляхів і нирок, багато питань залишаються нез’ясованими або недостатньо вивченими, що призводить до недостатньої ефективності лікування і нерідко хронізації перебігу захворювання [2]. Знижується ефективність традиційних препаратів широкого спектру, через що формується резистентність певних штамів, які є етіологічними збудниками інфекцій сечової системи [1, 3]. Тому 2 роки оновлюються Європейські рекомендації з лікування інфекцій сечового тракту [7, 8] та вносяться корективи до відповідних протоколів лікування. Згідно з останньою редакцією протоколу лікування дітей з інфекціями сечової системи і тубулоінтерстиціальним нефритом [4], серед цефалоспоринів третьої генерації для парентерального введення з’явився новий препарат — захищений сульбактамом цефтріаксон. На українському ринку цей препарат доступний під назвою Сульбактомакс.
 Сульбактомакс — цефалоспориновий антибіотик ІІІ покоління («Мілі Хелскере Лімітед», Великобританія). Діє бактерицидно за рахунок пригнічення синтезу клітинної стінки бактерій. Має широкий спектр протимікробної дії, що включає аеробні та анаеробні грампозитивні і грамнегативні мікроорганізми. Відноситься до бета-лактамних антибіотиків.
Сульбактомакс — цефалоспориновий антибіотик ІІІ покоління («Мілі Хелскере Лімітед», Великобританія). Діє бактерицидно за рахунок пригнічення синтезу клітинної стінки бактерій. Має широкий спектр протимікробної дії, що включає аеробні та анаеробні грампозитивні і грамнегативні мікроорганізми. Відноситься до бета-лактамних антибіотиків.
До складу Сульбактомаксу входять: цефтріаксон натрію та сульбактам натрію. Сульбактам — похідне основного ядра пеніциліну. Є необоротним інгібітором β-лактамаз і призначений для парентерального застосування. Сульбактам виявляє власну антимікробну активність. Здатність сульбактаму запобігати інактивації цефалоспоринів ферментами мікроорганізмів була підтверджена в дослідженнях із використанням резистентних штамів, щодо яких сульбактам виявляє синергізм з цефалоспоринами. Сульбактам також зв''язується з деякими білками, що зв''язують цефтріаксон, тому Сульбактомакс більш виражено діє на штами, чутливі до цефтріаксону, ніж сам цефтріаксон. Особливість дії сульбактаму полягає в тому, що під час розпаду його молекули відбувається руйнування ферменту (цефтріаксонази). Сульбактомакс має широкий спектр призначення: інфекції дихальних шляхів, шкіри, сечовидільної системи та ускладнені інфекції сечовидільної системи, урогенітальні інфекції, бактеріальна септицемія, інфекції кісток і суглобів, інфекції органів черевної порожнини, бактеріальний менінгіт, профілактика інфекцій при хірургічних втручаннях.
Вищеперераховані властивості Сульбактомаксу визначили його патогенетичну обґрунтованість в лікуванні дітей з гострим та хронічним пієлонефритом.
Метою даного дослідження була оцінка ефективності і безпеки препарату Сульбактомакс виробництва «Мілі Хелскере Лімітед» (Великобританія) у лікуванні дітей з гострим та хронічним пієлонефритом.
Завдання дослідження
Клінічне дослідження проводили як відкрите, контрольоване, рандомізоване у двох групах пацієнтів з контролем вихідного стану. Рандомізацію виконували методом випадкових чисел. Сьогочасне дослідження проводили відповідно до вимог, висунутих Державним фармакологічним центром МОЗ України до клінічних випробувань.
Матеріали і методи
У дослідженні брали участь 40 хворих, які знаходилися на стаціонарному лікуванні в міському дитячому нефрологічному центрі (клініці кафедри нефрології Національної медичної академії післядипломної освіти ім. П.Л. Шупика) і відповідали критеріям включення/виключення.
Критерії включення:
Критерії виключення:
Умови вибування пацієнтів з дослідження:
Пацієнти перебували у активній стадії гострого (20 пацієнтів) та хронічного пієлонефриту (20 пацієнтів) і отримували Сульбактомакс за схемою призначення досліджуваного препарату. Кожний пацієнт отримував призначене лікування відповідно до інструкції до препарату в лікарській формі порошок для приготування розчину для ін''єкцій по 750 мг та 1500 мг. До початку й у кінці дослідження кожний пацієнт проходив клініко-лабораторне обстеження відповідно до протоколів МОЗ України. Усі дані обстеження пацієнтів заносились до історії хвороби.
Дані, визначені як критерії ефективності і переносимості, оцінювали за запропонованою у відповідному розділі шкалою, статистично обробляли і порівнювали до і після лікування. На підставі отриманих результатів формували висновки про ефективність і безпеку досліджуваного препарату. Дані клінічних і лабораторних досліджень статистично обробляли методом варіаційної статистики з урахуванням непараметричного критерію χ2. Для оцінки достовірності отриманих результатів прийнято рівень значимості р < 0,05.
Тривалість дослідження для кожного пацієнта склала 3–4 доби. Загальна тривалість дослідження — 10 діб для гострого пієлонефриту, 14 діб — для хронічного пієлонефриту.
Пацієнти І і ІІ груп (n = 40) у перші 3–4 доби перебування у стаціонарі отримували внутрішньовенно Сульбактомакс із розрахунку 50–
Ступінчата терапія призначалась за умови досягнення позитивної динаміки — нормалізації температури тіла протягом перших двох діб, покращення/стабілізації клінічної картини, можливості перорального прийому їжі і рідини, відсутності порушення всмоктування в ШКТ, низької ймовірності лікарських взаємодій.
Для оцінки терапевтичної ефективності і переносимості досліджуваного препарату пацієнтам проводили обстеження із застосуванням наступних методів:
Для оцінки ефективності та переносимості препарату визначили наступні критерії ефективності:
Оцінка ефективності препарату проводилася дослідником за наступною шкалою:
Переносимість препарату оцінювали на підставі симптомів та суб''єктивних відчуттів, які повідомлялись хворим та його батькам, і об''єктивних даних, отриманих в процесі лікування. Враховувалась динаміка лабораторних показників, а також частота виникнення і характер побічних реакцій.
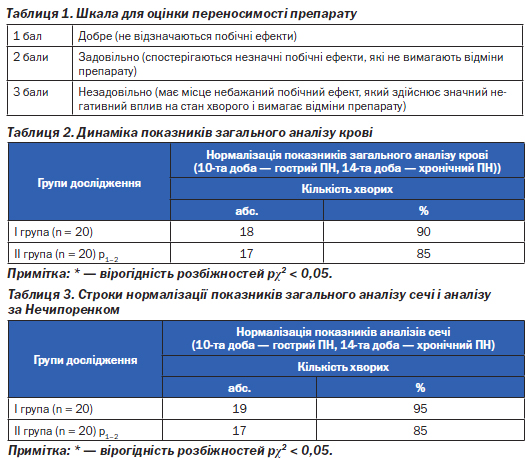
Переносимість препарату оцінювали в балах (табл. 1)
Клінічне випробування проводилось відповідно до Закону України «Про ліки» і принципами Гельсінкської декларації і ICH GCP.
Результати дослідження та їх обговорення
У дослідженні брали участь 40 дітей з мікробно-запальними захворюваннями нирок, серед яких 20 пацієнтів (І група) — з гострим пієлонефритом у активній стадії без порушення функції нирок (неускладненим та ускладненим на тлі вроджених аномалій розвитку органів сечовивідної системи та нейрогенних розладів сечовипускання), 20 пацієнтів (ІІ група) з хронічним пієлонефритом у активній стадії без порушення функції нирок (неускладненим та ускладненим). Серед них 29 пацієнтів жіночої статі (72,5 %) і 11 — чоловічої (27,5 %). Вік досліджуваних пацієнтів склав від 1 місяця до 18 років (5,6 ± 0,4). Інтоксикаційний синдром у дітей з гострим та хронічним пієлонефритом у активній стадії був представлений наявністю температури в усіх пацієнтів, зниженого апетиту (67,5 %), блідості шкірних покровів (65 %), періорбітального ціанозу (27,5 %). Клінічний стан дітей у більшості випадків розцінено як середньої важкості. Інтоксикаційний синдром поєднувався з класичними лабораторними ознаками мікробно-запального процесу — нейтрофільною лейкоцитурією у поєднанні з бактеріурією, збільшеною ШОЕ, лейкоцитозом, зсувом лейкоцитарної формули вліво, у 30 % випадків з анемією. У дітей обох груп на 3–4-ту добу лікування зменшились, а у 67,5 % зникли симптоми інтоксикації — нормалізувалась температура тіла, покращився апетит, шкірні покрови набули блідо-рожевого і рожевого кольору. Динаміка температури була важливим критерієм переводу дітей обох груп на пероральний прийом антибіотику. Аналіз отриманих клініко-лабораторних результатів продемонстрував, що застосування Сульбактомаксу в ступінчатій терапії при мікробно-запальному процесі нирок у дітей було ефективним. Результати вірогідно не відрізнялись в обох групах, які парентерально отримували Сульбактомакс протягом певного періоду лікування. Двохетапне застосування антибактеріальних препаратів з переходом від парентерального до перорального шляху введення продемонструвало, що нормалізація таких показників, як ШОЕ, кількість лейкоцитів, лейкоцитарної формули зареєстрована на 10-ту добу у 18 хворих (90 %) І групи з гострим пієлонефритом і на 14-ту добу — у 17 пацієнтів (85 %) ІІ групи з хронічним пієлонефритом. Дані наведені у табл. 2.
У 19 пацієнтів І групи (95 %) з гострим пієлонефритом на 10-ту добу ступінчатої терапії зареєстрована нормалізація показників аналізів сечі (загального і за Нечипоренком). Дані наведені у табл. 3.
14-денний курс лікування хронічного пієлонефриту із застосуванням Сульбактомаксу продемонстрував повну нормалізацію аналізів сечі у 85 % пацієнтів ІІ групи.
Отже, висока ефективність лікування зареєстрована у 90 % пацієнтів І групи і у 85 % пацієнтів ІІ групи. Помірна ефективність лікування відмічена у 10 % пацієнтів І групи і у 15 % пацієнтів ІІ групи відповідно.
Показники біохімічного аналізу крові до та після призначеного лікування в пацієнтів обох груп знаходились у межах фізіологічних норм. Сульбактомакс добре переносився пацієнтами, не викликав у більшості пацієнтів побічних дій.
Побічні ефекти з боку нервової системи, шлунково-кишкового тракту, серцево-судинної і дихальної системи у хворих не відзначались. Тільки у 2 пацієнтів на фоні прийому Сульбактомаксу зафіксовано появу незначної алергічної висипки.
Оцінка переносимості препарату Сульбактомакс документована нами як добра. Батьки пацієнтів відзначали зручність застосування Сульбактомаксу.
Для кожного пацієнта були підібрані індивідуальні дози, зазначені в листі призначень і листі інфузійної терапії, таким чином, застосування Сульбактомаксу не створювало проблем для пацієнтів і середнього медичного персоналу.
Отже, новий препарат захищеного цефтріаксону може повністю замінити звичайний цефтріаксон задля зменшення невдач в лікуванні пієлонефриту [5, 6]. Згідно з сучасними знаннями, ступінчата терапія цефалоспоринами ІІІ генерації, які розглядаються у дітей як перша лінія в лікуванні пієлонефриту, передбачає внутрішньовенне введення одного препарату і перехід на іншій пероральний цефалоспорин (у даному випадку це був цефіксим) [7].
Висновки
1. Результати дослідження продемонстрували високу ефективність, безпеку і переносимість препарату Сульбактомакс
1. Иванов Д.Д. Комментарий к Европейскому руководству по лечению инфекций мочевой системы // Клінічна імунологія. Алергологія. Інфектологія. — 2007. — № 6 (11). — С. 53-57.
2. Іванов Д.Д. Нефрологія в практиці сімейного лікаря / Д.Д. Іванов, М.О. Корж. — К.: Аврора плюс, 2006. — 272 с.
3.Мальцев С.В. Антибактериальная терапия пиелонефрита у детей // Педиатрия. — 2008. — Т. 87, № 4. — С. 130-135.
4. Протокол лікування дітей з інфекціями сечової системи і тубулоінтерстиціальним нефритом. Наказ МОЗ України № 627 від 03.11.08.
5. Рафальский В.В. Влияние резистентности возбудителей инфекций мочевыводящих путей на исходы антибактериальной терапии // Урология. — 2008. — № 4. — С. 3-9.
6. Akova M. Комбинации антибиотиков с ингибиторами β-лактамаз, содержащих сульбактам // Український медичний вісник. — 2008. — № 4. — С. 31-32.
7. Cohrane Database Syst Rev. — 2007. — 24 Dec., 4. — CD003772.
8. Guidelines on The Management of Urinary and Male Genital Tract Infections // M. Grabe (Chairman), M.C. Bishop, T.E. Bjerklund-Johansen, H. Botto, M. Çek, B. Lobel, K.G. Naber, J. Palou, P. Tenke. — EAU, 2008. — P. 40-47.
