Газета «Новости медицины и фармации» 5(311) 2010
Вернуться к номеру
Ефективність та безпечність використання рофекоксибу для знеболення в післяопераційному періоді в гінекологічній практиці
Авторы: І.І. Хаща, д.м.н., професор кафедри акушерства і гінекології Ужгородського національного університету В.М. Іваньо, завідувач відділенням анестезіології, реанімації та інтенсивної терапії Ужгородського міського перинатального центру
Версия для печати
З гуманістичної точки зору чи не найбільшим досягненням сучасної медицини є можливість позбавити людину від страждань внаслідок болю. Адже біль — дуже поширене явище, він є симптомом різноманітних патологічних процесів і захворювань, а також супроводжує різні медичні маніпуляції та оперативні втручання, у тому числі й перебіг післяопераційного періоду [2].
Проблема адекватного знеболення в післяопераційному періоді займає перше місце в сучасній хірургії. Новітні технології та методики операцій суттєво розширюють показання до хірургічного лікування, із кожним роком збільшується кількість операцій як у стаціонарах, так і у клініках хірургії одного дня. Якщо під час операції питання знеболення вирішується практично в усіх випадках, то після операцій пацієнти потребують індивідуального моніторінгу анальгезії, особливо в перші 2–3 доби. Незважаючи на широкий арсенал препаратів як наркотичного, так і ненаркотичного складу, призначення схеми знеболення в післяопераційному періоді залишається актуальною проблемою. Сучасна фармацевтична промисловість пропонує дуже великий асортимент медикаментів для позбавлення від болю. Вибір конкретного препарату залежить від багатьох факторів. До них, на нашу думку, можна віднести особливості застосування (обмеження використання наркотичних препаратів), шлях введення, швидкість і тривалість ефекту, наявні протипоказання, можливі побічні дії, частоту прийому, можливість комбінування з іншими препаратами, досвід використання, вартість, особисті уподобання лікаря. Для сучасних знеболювальних засобів також важливою є здатність замінити «незручні» ліки (наприклад, наркотики, щоб максимально спростити процедуру їх зберігання й обліку). Суттєве значення має розуміння основних патогенетичних механізмів реалізації протибольового ефекту, що також може сприяти правильному вибору препарату. Тканинне запалення відіграє важливу роль у механізмах центральної сенситизації і, відповідно, у формуванні болю. Гострий больовий синдром у післяопераційному періоді є серйозною медико-соціальною проблемою, що має ще й велике економічне значення.
У зв''язку з цим основною задачею підвищення ефективності післяопераційного знеболення на сучасному етапі є профілактика хронізації гострого больового синдрому. Це є показанням для обов''язкового включення в схему лікування післяопераційного болю нестероїдних протизапальних препаратів (НПЗП) [5]. У різних європейських клініках частота призначення даних препаратів як базису післяопераційного знеболення становить від 45 до 99 % [3]. Поряд із цим відзначається обмеження традиційного внутрішньом''язового призначення опіатних анальгетиків, що обумовлено низькою ефективністю і значною кількістю побічних ефектів даної методики.
Упродовж тривалого часу НПЗП вважали периферичними анальгетиками, які здатні через зворотню блокаду циклооксигенази (ЦОГ) пригнічувати в тканинах синтез медіаторів запалення, насамперед простагландинів. Відтак були отримані докази центральної дії НПЗП та виявлено, що НПЗП пригнічують таламічну відповідь на больову стимуляцію й перешкоджають підвищенню концентрації простагландинів у спинномозковій рідині, що гальмує розвиток вторинної гіпералгезії.
Фактором, що лімітує використання НПЗП, є відносно висока частота побічних ефектів навіть при короткочасному або ситуативному їх використанні (у 25 % випадків, при цьому в 5 % пацієнтів ці ускладнення можуть бути загрозливими для життя) [6]. Усе це спонукає провідні фармацевтичні компанії продовжувати пошук у напрямі удосконалення протизапальних засобів, насамперед із метою зниження їх побічних дій і покращення профілю безпеки при їх застосуванні за різними показаннями.
Безперервний процес пошуку більш безпечних НПЗП сприяв появі специфічних інгібіторів 2-го ізоферменту циклооксигенази (ЦОГ-2) — коксибів. Їх перевага над неселективними НПЗП була обгрунтована зменшенням токсичного впливу на шлунково-кишковий тракт [7]. Вивчення ролі ЦОГ-2 та ефектів її вибіркових інгібіторів виявило деякі нові потенційні сфери застосування цих засобів (профілактика рецидивів пухлин, попередження хвороби Альцгеймера), що обумовило початок великих рандомізованих контрольованих досліджень. Однак із часом з''явилися дані про розвиток інших серйозних побічних ефектів цих препаратів — інфаркту міокарда, інсульту, що й стало причиною для відкликання препарату рофекоксиб із фармацевтичного ринку США у 2004 році й зупинення досліджень ефективності інших препаратів (напроксен, целекоксиб) [1]. Слід підкреслити, що побічні серцево-судинні ефекти були встановлені при тривалому (хронічному) застосуванні рофекоксибу та інших НПЗП, а також посилювалися із віком.
Незважаючи на це, одним із препаратів групи селективних НПЗП, що в останні роки широко застосовується й зареєстрований в Україні, є рофекоксиб, який має таблетовану та ін''єкційну форми випуску [4].
Як зазначають виробники, із серйозних побічних ефектів із частотою близько 2 % зустрічаються артеріальна гіпертензія, посилення симптомів застійної серцевої недостатності, порушення серцевого та мозкового кровообігу, із несерйозних — диспептичні розлади із частотою близько 2 % (печія, дискомфорт в епігастральній ділянці, нудота, діарея), набряки нижніх кінцівок (2 %), підвищення активності трансаміназ, блювання (близько 1 %). Зрідка зустрічаються виразки слизової оболонки рота, запаморочення, сплутаність свідомості, сонливість, порушення функцій нирок, алергічні реакції (висипання, свербіж, кропивниця, ангіоневротичний набряк).
Таким чином, вищезазначене свідчить про необхідність продовження пошуку оптимальних методів, препаратів, схем післяопераційного знеболення, зокрема в гінекологічній практиці.
Метою нашого дослідження було вивчення ефективності знеболення та безпечності застосування в післяопераційному періоді препарату рофекоксиб.
Матеріал і методи
У дослідження були включені 60 пацієнток гінекологічного відділення Ужгородського міського перинатального центру, яким було проведено оперативне лікування в обсязі, що залежав від основного діагнозу, із обов''язковою лапаротомією. Перед операцією всі жінки були обстежені в доступному обсязі, згідно з чинними наказами щодо передопераційного обстеження, та були допущені до операції. Пацієнтки були поділені на дві групи, які не відрізнялися між собою за середнім віком, екстрагенітальними захворюваннями, ступенем операційного ризику. Передопераційна підготовка (премедикація) та інтраопераційне анестезіологічне забезпечення в обох групах були проведені однотипно. У післяопераційному періоді застосовувалися дві різні схеми з використанням різних препаратів для анальгезії. У досліджувану (основну) групу увійшли 30 жінок, із яких 15 пацієнток перенесли екстирпацію матки, 7 — операції з приводу випадіння матки (передня та задня кольпоперинеопластики з вентрофіксацією матки) та 8 — лапаротомії з приводу апоплексії яєчників та позаматкових вагітностей. Дані пацієнтки в післяопераційному періоді отримували 50 мг рофекоксибу (Денебол) на добу внутрішньом''язово упродовж 4 діб та 1 мл 2% розчину промедолу внутрішньом''язово відразу після операції.
У випадках сильного болю додатково призначався анальгін 50% 2 мл із димедролом 1% 1 мл внутрішньом''язово (за проханням). Усі пацієнтки в досліджуваній групі були проінформовані відносно тактики післяопераційного знеболення й дали згоду на призначення Денеболу.
Критерієм виключення із досліджуваної групи вважали прийом упродовж тривалого часу НПЗП перед операцією з приводу основного екстрагенітального захворювання (наприклад, ревматоїдний артрит), а також наявність ішемічної хвороби серця, цереброваскулярної патології. Такі пацієнтки були автоматично включені до контрольної групи.
До контрольної групи ввійшли 30 жінок, із яких 14 пацієнток перенесли екстирпацію матки, 8 — операції з приводу випадіння матки (передня та задня кольпоперінеопластики з вентрофіксацією матки) та 8 — лапаротомії з приводу апоплексії яєчників та позаматкових вагітностей. Контрольна група отримувала промедол 2% по 1 мл внутрішньом''язово 2–3 рази на добу упродовж перших 2 діб після операції та кетанов 30 мг внутрішньом''язово, анальгін 50% 2 мл з димедролом 1% 1 мл внутрішньом''язово (за проханням) у наступні дні.
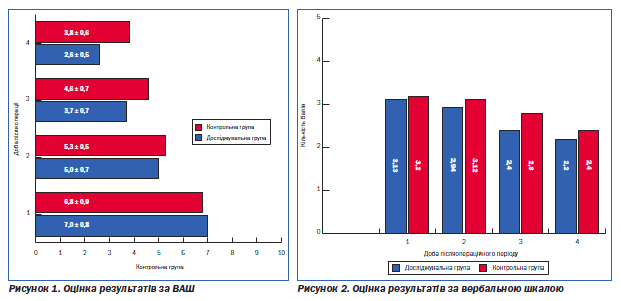
Вивчення ефективності знеболювальної терапії проводили за найбільш поширеною методикою — оцінка болі за 10-бальною візуально-аналоговою шкалою (ВАШ).
Ця шкала являє собою відрізок прямої довжиною 10 см (100 мм), без поділок і цифр, початок якого має позначення «біль відсутній», а кінець — «нестерпний біль». Пацієнтка робила позначку на цьому відрізку в точці, що відображає інтенсивність її болю.
Також був використаний метод вербальної рейтингової шкали (рис. 2), за якою інтенсивність болю визначали в балах (від 0 до 5) за такими критеріями:
0 — немає болю;
1 — немає болю у спокої, слабкий біль при рухах, кашлі, глибокому вдиху;
2 — слабкий біль у спокої, помірний біль при рухах, кашлі та глибокому вдиху;
3 — помірний біль у спокої, сильний біль при рухах, кашлі і глибокому вдиху;
4 — сильний біль у спокої та при рухах;
5 — нестерпний біль.
Опитування пацієнток проводили починаючи з 1-ї післяопераційної доби з проханням оцінити ефективність знеболення за час, що минув. Паралельно проводилися оцінка переносимості лікування та контроль побічних реакцій. Уся отримана інформація заносилася в карту спостереження.
Як свідчать результати проведених досліджень, рофекоксиб має виражений анальгетичний ефект навіть порівняно з традиційною схемою післяопераційного знеболення, що включає використання опіоїдних препаратів. І якщо оцінка болю за різними методиками в перші дні післяопераційного періоду засвідчила відсутність вірогідної різниці між жінками
в основній і контрольній групах, то починаючи з 3-ї доби ми відмітили кращу динаміку зменшення больових відчуттів у пацієнток основної групи. Практична цінність застосування в/м форми Денеболу з метою знеболення підкреслюється пацієнтками вже на другу добу післяопераційного періоду, особливо під час ранньої активізації — сідання, вставання, ходіння, що вимагається відповідними протоколами з профілактики тромбоемболічених ускладнень в післяопераційному періоді. Оцінка переносимості препарату засвідчила відсутність побічних реакцій у пацієнток основної групи упродовж лікування та впливу на згортальну систему крові. Враховуючи наявність випадків нестабільного постачання в медичні заклади промедолу, Денебол може застосовуватися як його альтернатива.
Висновки
1. Використання препарату Денебол є ефективним у протибольовому лікуванні після гінекологічних операцій.